Sanidad vegetal
Análisis de la entomofauna benéfica en cultivos de maíz transgénico y convencional, Córdoba-Colombia
Analysis of benefic entomofauna in transgenic and conventional corn crops, Córdoba-Colombia
Análisis de la entomofauna benéfica en cultivos de maíz transgénico y convencional, Córdoba-Colombia
Temas Agrarios, vol. 23, núm. 2, 2018
Universidad de Córdoba
Recepción: 21 Diciembre 2017
Aprobación: 24 Mayo 2018
Resumen: La adopción de los cultivos genéticamente modificados (OGM) ha llevado a la necesidad de evaluar los impactos sobre los organismos no objetivos. Para ello se estudio el impacto del cultivo transgénico maíz (Zea mays) sobre la entomofauna benéfica. Se colectaron artrópodos en ocho lotes de maíz convencional y transgénico mediante las técnicas de Berlesse, Pitfall, Jama y Trampas amarillas. El análisis de diversidad se realizó utilizando el método propuesto por Jost (2006) a través de tres valores q = 0, 1 y 2 y se construyeron curvas de rango-abundancia. Para la formación de los grupos funcionales, se realizó un análisis de conglomerados empleando el método de encadenamiento jerárquico de Ward. Se colectaron 6,932 individuos entre cultivos convencionales y transgénico, registrando 102 taxones discriminados en 6 especies, 42 géneros y 54 familias. El cultivo transgénico registró la mayor abundancia con 51,60% y el convencional un 48,39%. La curva de rango-abundancia no indica diferencias entre los cultivo para las localidades de Cereté y San Pelayo. El dendrograma arrojo ocho (8) grupos funcionales. Al analizar la diversidad alfa verdadera 0D, se obtuvo en ambas localidades los ocho (8) grupos funcionales; la diversidad verdadera en el cultivo convencional fue 1D = 6,76 y el transgénico 1D = 6,83. Para el orden 2D fue 6,17 en convencional y 6,21 en transgénico; se puede concluir que en estos resultados no se observaron diferencias significativas con relación a los tres perfiles de diversidad entre los cultivos convencional y transgénico.
Palabras clave: Agroecosistema, Biodiversidad, Benéficos, Maíz Bt, Grupos funcionales.
Abstract: The adoption of genetically modified crops (GMOs) has led to the need to assess impacts on non-target organisms. For this, the impact of transgenic maize (Zea mays) on beneficial entomofauna was studied. Arthropods were collected in eight lots of conventional and transgenic maize using the techniques of Berlesse, Pitfall, Jama and Yellow traps. The diversity analysis was performed using the method proposed by Jost (2006) through three values q = 0, 1 and 2 and range-abundance curves were constructed. For the formation of the functional groups, a cluster analysis was performed using Ward's hierarchical chaining method. 6,932 individuals were collected between conventional and transgenic crops, registering 102 taxa discriminated in 6 species, 42 genera and 54 families. The transgenic crop recorded the highest abundance with 51,60% and the conventional one 48,39%. The range-abundance curve does not indicate differences between the crops for the municipalities of Cereté and San Pelayo. The dendrogram showed eight (8) functional groups. When analyzing the true alpha diversity 0D, the eight (8) functional groups were obtained in both locations; The true diversity in conventional culture was 1D = 6,76 and the transgenic 1D = 6,83. For the 2D order it was 6,17 in conventional and 6,21 in transgenic; it can be concluded that in these results no significant differences were observed in relation to the three diversity profiles between conventional and transgenic crops.
Keywords: Agroecosystem, Biodiversity, Beneficial, Bt maize, Functional groups.
INTRODUCCIÓN
A nivel nacional e internacional existe una alta incertidumbre y controversia sobre los riesgos ambientales asociados a la introducción y rápida expansión de los OGM (Conner et al. 2003). Se estima que en los agroecosistemas únicamente el 3% de las especies se comporta como plaga y el 97% está integrado por fauna auxiliar, de la cual, el 35% está representado por enemigos naturales de las plagas, entre los que destacan diversas especies de insectos depredadores y parasitoides, y el 62% restante lleva a cabo otras funciones (Nájera y Souza 2010).
Tiendo en cuenta que la fauna auxiliar representa un alto porcentaje dentro del agroecosistema, una de las mayores preocupaciones son los posibles riesgos de ésta tecnología sobre la entomofauna benéfica u organismos no objetivos en los cultivos, que prestan servicios ambientales importantes como biocontroladores y descomponedores (Naranjo 2005; Marvier et al. 2007). La introducción comercial de cultivos transgénicos ha generado la necesidad de evaluar los posibles impactos de esta tecnología en el medio ambiente, y los efectos sobre los organismos no objetivos. Algunos estudios han indicado efectos tóxicos de las proteínas insecticidas Bt en especies no objetivo, incluyendo otros herbívoros, dedepredadores y parasitoides (Hilbeck et al. 1999; Schuler et al. 1999; O’Callaghan et al. 2005; Romeis et al. 2014). Ademas, la reducción de las poblaciones de insectos fitofagos, debido a la presencia de la proteína insecticida en la planta GM, puede representar un impacto en la estructura de la población de las especies de parasitoides y depredadores (White y Andow 2005).
Las aproximaciones utilizadas en la valoración de los impactos de cultivos genéticamente modificados (GM), es que a menudo solo se enfocan en la evaluación de los efectos sobre la biodiversidad estructural (i.e. especies), sin contemplar de manera explícita los efectos sobre los procesos y funciones ecosistémicas (control biológico, polinización, ciclaje de nutrientes) (Corpoica 2012). Estudios de cultivos transgénicos Bt han revelado que la exposición a las proteínas Cry varía ampliamente entre los diferentes grupos y especies de alimentación herbívora (Romeis et al. 2014). Artrópodos como los depredadores o parasitoides están principalmente expuestos a las toxinas producidas en la planta cuando se alimentan o parasitan herbívoros que se han alimentado con cultivos transgénicos. Existe evidencia de que la concentración del compuesto activo para los artrópodos suele diluirse a medida que se mueve hacia la cadena alimentaria (Meissle y Romeis 2012; Romeis et al. 2014).
Por otra parte, desde el punto de vista medioambiental, una posible ventaja del uso del maíz transgénico sería la reducción de las aplicaciones de insecticidas especialmente el ingrediente activo de amplio espectro, ya que su efecto puede ser más impactante sobre la persistencia de la comunidad de insectos (Dively 2005; Naranjo 2005). En este sentido, y teniendo en cuenta que las diferentes actividades desarrolladas por el ser humano pueden generar perjuicios sobre el medio ambiente y todos los componentes integradores del mismo, se pretende reconocer la entomofauna benéfica asociada al cultivo de maíz en el departamento de Córdoba.
MATERIALES Y METODOS
El estudio se llevó a cabo en los municipios de Cereté (8°53’11” N y 76°12’35” W) y San Pelayo (8°75’39” N y 76°09’51” W) del departamento de Córdoba-Colombia. Esta región presenta una época de lluvias que van de Mayo a Noviembre y una época seca que va de Diciembre a Abril, con una temperatura anual promedio de 28°C, precipitaciones de 1380 mm, evapotranspiración potencial de 1240 y con una humedad relativa promedio del 81%.
Se colectaron artrópodos en lotes comerciales de algodón Bt y convencional en los municipios de Cereté y San Pelayo. El material vegetal evaluado fue: (1) línea isogénica (P-30F32) tolerante al glifosato y (2) un genotipo con tecnología Bt (P-3032WHR). En cada localidad se dispuso de cuatro lotes.
En cada lote se implementaron cinco métodos de muestreo acorde al micro hábitat, para la artropofauna del suelo se utilizó el método de Berlesse y Pitfall. En el primer método la muestra se tomó en cuatro sitios de muestreos para cada lote, con un barreno tipo “Cup Cutter” con capacidad para extraer 1.500 g de suelo y profundizar uno 20 cm, luego se llevaron a los embudos Berlesse por 24 horas; las trampas Pitfall se ubicaron en diez puntos sobre el surco y entre plantas, este método consistió en instalar a nivel del suelo un vaso plástico de 12 onzas perforado, dentro de esta base se colocó un vaso de 3,5 onzas.
Para la captura de artrópodos aéreos y en estratos herbáceos se utilizaron redes entomológicas y trampas adhesivas. Para el muestreo con redes entomológicas se escogieron aleatoriamente diez puntos en cada lote, en los cuales se realizaron diez pases dobles de jama (pdj); esto se repitió semanalmente hasta que el cultivo alcanzó una altura promedio de 1,5 m. En las trampas adhesivas se utilizaron placas plásticas amarillas (PPA) de dimensiones 20 x 10 cm y con cuadriculas de 2 cm2 fijadas en una vara de madera de 2,2 m de longitud, como adhesivo a la placa se le untó grasa mecánica.
Las muestras colectadas fueron llevadas al laboratorio en bolsas plásticas, debidamente selladas y rotuladas, donde fueron identificadas hasta la categoría taxonómica más específica posible con ayuda del estereoscopio (Advanced optical JSZ6S con cámara incorporada INFINITY 1) y utilizando claves taxonómicas (Fernández y Sharkey 2006; Borror y White 1998; Triplehorn y Johnson 2005). El material biológico fue preservado en seco de acuerdo a la naturaleza de los ejemplares y se encuentran disponibles en colecciones del laboratorio de entomología de la universidad de Córdoba.
En la representatividad del muestreo de los datos obtenidos se construyó una matriz de abundancia y riqueza de especies empleando el programa Microsoft Excel®; con esta información se realizaron gráficas de abundacia relativa y riqueza de especies que conforman la comunidad de artropofauna benéfica en cultivos sembrados con tecnologia Bt y cultivos convencionales.
La determinación de los grupos funcionales, se realizó con un análisis de conglomerados empleando atributos funcionales (Casanoves et al. 2011). Se hizo un análisis utilizando solo a los insectos benéficos. Se empleó el método de encadenamiento jerárquico de Ward y cuatro medidas de similitud (Dice, Bray-Curtis, Jaccard y emparejamiento simple) que produjeron cuatro agrupamientos.
Cada uno de los taxones reportados en el estudio se identifico rasgos funcionales que reflejan las estrategias de adquisición de recursos y los procesos ecosistémico a los que se encuentran asociados. Con base en los rasgos funcionales descritos, se construyó una matriz de variables indicadoras (cero y uno) con categorías no excluyentes realizando un análisis de conglomerados utilizando el método de encadenamiento jerarquico de Ward y las medidas de similaridad de Jaccard, emparejamiento simple, Sorensen (Bray-Curtis) y Dice para la construcción de la matriz de similaridad/distancia. Para seleccionar el agrupamiento que mejor representaba los grupos funcionales, se usó como criterio la correlación cofenética (Rohlf y Sokal 1981).
La diversidad de artrópodos se utilizó el método propuesto por Jost (2006); la diversidad y el grado de recambio de especies reales se calculó a través de tres valores de q= 0, 1 y 2, utilizando el paquete iNEXT según Chao y Jost (2012), Moreno et al. (2011). La completitud del muestreo se estimó mediante el análisis de coberturas estandarizadas de las muestras (IC = 99%), utilizando el paquete iNEXT. Igualmente, se generaron intervalos de confianza al 95% como medida de interpolación o extrapolación del cálculo de la riqueza evaluada propuesta por Chao y Jost (2012). Finalmente se construyeron curvas de rango-abundancia o curvas de Whittaker según Magurran (1998), Feinsinger (2003), en las que se usó el número de especies y de individuos por especie registrados en cada tipo de cultivo. La curva se graficó de acuerdo con el logaritmo de la proporción de cada especie p (n/N), y los datos se ordenaron desde la especie más abundante a la menos abundante (Magurran 1998).
RESULTADOS Y DISCUSIÓN
El total de individuos recolectados en los cultivos convencional y transgénico fue de 6,932 durante la fase de muestreo, en total se registraron 102 taxones discriminados en 6 especies identificadas, 42 géneros y 54 familias. Para el cultivo transgénico se registró la mayor abundancia con 3577 individuos, equivalentes a un 51,60% de la representatividad total del muestreo; y para el cultivo convencional 3355 individuos, siendo este un 48,39% de los especímenes colectados.
De acuerdo al total recolectado en los diferentes sistemas de trampeos se pudo evidenciar que la mayor representatividad de individuos estuvo marcada por la clase Insecta, con un 76,47%, en comparación con las clases Arachnida y Myriapoda donde la proporción de capturas fue de 22,55% y 0,98%. Los taxones de artrópodos benéficos encontrados y su representatividad según ordenes taxonómicos registro que el orden Hymenoptera fue el más abundante, representando el mayor número de individuos en cultivo convencional (CC) con el 35,14% y para el cultivo transgénico (CT) con el 34,27%, seguido por el Orden Coleóptera con 24,83% (CC) y 24,13% (CT), luego le sigue el Orden Diptera con 12,02% (CT) y 11,59% (CC), finalmente el Orden Araneae registro un 8,05% (CT) y 7,72% (CC); siendo estos los ordenes más representativos. Estos resultados al ser analizados representan valores similares a los reportados por Berry et al. (1996), quien encontro en sus muestreos que las poblaciones más altas fueron las de himenópteros (69%) en parcelas de zanahorias; y a su vez, indico que no existen diferencias entre los dos sistemas.
La abundancia de la artropofauna benéfica reportada en cultivo transgénico puede atribuir a la menor aplicación de insecticidas. Estos resultados coinciden con los de Pérez et al. (2009) y Benamú (2010) quienes argumentan que la aplicación de insecticidas para el caso del cultivo convencional ejerce un efecto negativo sobre la disminución de la diversidad en poblaciones de artrópodos. Estudios realizados por Dively (2005) y Chaves et al. (2016) en Brasil sobre la comunidad de insectos no objetivo en el ecosistema agrícola maíz, demostró que el impacto de los insecticidas en cultivos convencionales puede ser más fuerte y de amplio expectro en la estructura de las comunidades.
En cuanto a los insectos depredadores, se determinó que en el cultivo transgénico el número de individuos (3,11) fue mayor que en el cultivo convencional (2,90). Las familias predadoras más representativas fueron los Formicidae, Coccinellidae, Carabidae, Staphylinidae, Araneidae, Salticidae y Reduviidae expresando comportamientos no muy marcado pero si diferenciado para ambos cultivos; este comportamiento coincide con estudios realizado por Lobos (2003) sobre la evaluación de la fauna benéfica en cultivos de algodón convencional y transgénicos con expresión de la toxina del Bacillus thuringiensis, en donde argumenta que esta tendencia puede estar influenciada por la ecología nutricional, atributos biológicos como especificidad y estacionalidad y presas de preferencia.
En cuanto al grupo de parasitoides, este estuvo representado por las familias Braconidae y Eulophidae para los cultivos convencionales con un 28,68% y 28,68% respectivamente; por su parte Scelionidae y Encyrtidae se expresaron mejor para los cultivos transgénicos con un 28% y 24%, respectivamente; las cuales de acuerdo a sus roles y habitos alimenticios, registraron abundancias relativas diferentes para ambos cultivos. A pesar de las diferencias encontardas en la abundancia de las famlias y al realizar la prueba de Mann-Whitney; esta no mostró diferencias significativas entre la diversidad de familias y el tipo de cultivo (U = 1,63 p = 0,11).
La mayor incidencia de los parasitoides fue determinada por el cultivo convencional con las especies Telenomus sp., Euplectrus sp. y Archita sp. con el 19%, 15% y 10% respectivamente, siendo estas las especies de mas renombre dentro del control biológico; sin embargo, Copidosoma trucantellum fue la especie que mayor representatividad expreso dentro los muestreos en el cultivo transgénico con un 25%, superando los registros de individuos del cultivo convencional. Pero a pesar de esto, la prueba de Mann-Whitney no mostró diferencias significativas entre la diversidad de especies y el tipo de cultivo (U= 2,40 p = 0,53).
Es bueno resaltar el comportamiento que expresaron las arañas en los cultivos de maíz convencionales y transgénico, donde principalmete las especies Trachela sp. y Lycosa sp. que predominan en el estrato de suelo, la especie Lycosa sp. presentó la mayor abundancia con un 10% para el cultivo convencional y 14% en transgénico y Trachela sp. con un 11% para el cultivo convencional y 9% en transgénico. En cambio, para al estrato herbáceo las especies predominantes fueron Oxiope sp. y Alpaida sp. Siendo la especie más abundante Oxiope sp., cn un 14% para ambos cultivos y Alpaida sp. 12% para el cultivo convencional y 15% en transgénico.
Esto es acorde con lo evidenciado por Riechert et al. (1997); Greenstone (1999), quienes en experimentos en campo en cultivos transgénicos de soja y trigo han demostrado la capacidad que presentan las arañas para reducir algunas poblaciones de insectos plagas. A pesar de las grandes preferencias y comportamiento de las especies en nuestro estudio la prueba de Mann-Whitney no mostró diferencias significativas entre la diversidad de especies y el tipo de cultivo (U = 638,00 p = 0,91).
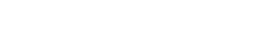
Al analizar la comunidad de artrópodos presentes para los dos tipos de cultivo; convencional y transgénico mediante las curvas de rango-abundancia en general se observa que la pendiente de las graficas no indican diferencias entre los dos tipos de cultivo para las localidades de Cereté y San Pelayo (Figura 1)
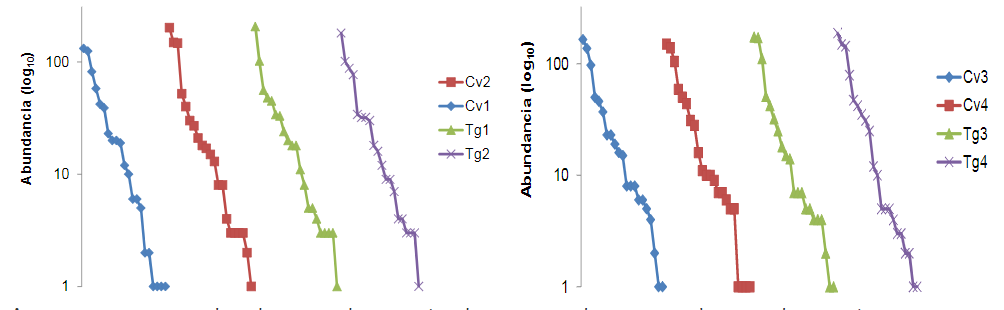
En términos de la riqueza de órdenes, el análisis mostró que hubo poca variación entre el cultivo convencional y transgénico, solo uno de los lotes de maíz transgénico en la localidad de Cereté mostró valores más bajos que los lotes convencionales. Igualmente, en la localidad de San Pelayo, uno de los lotes de maíz convencional obtuvo una riqueza más alta que los cultivos transgénicos (Figura 2).
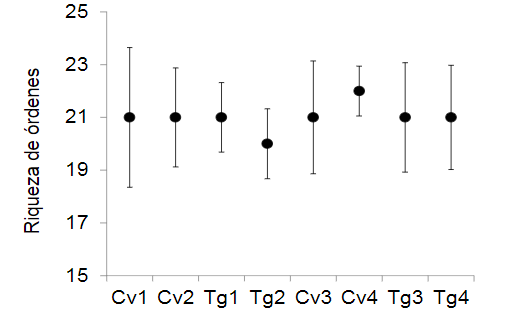
Los grupos funcionales de la artropofauna benéfica entre los diferentes lotes de las localidades de Cerete y San Pelayo, cambia con relacion al analisis de diversidad realizados a todos los artrópodos. El coeficiente de correlación cofenética reveló que el mejor agrupamiento fue el generado por la similaridad de Bray-Curtis (r=0,81). El resto de medidas de similitud empleadas presentaron correlaciones más bajas (Encadenamiento simple = 0,80; Jaccard = 0,57; Dice: 0,80). El dendrograma seleccionado mostró la formación de ocho (8) grupos funcionales (Figura 3).
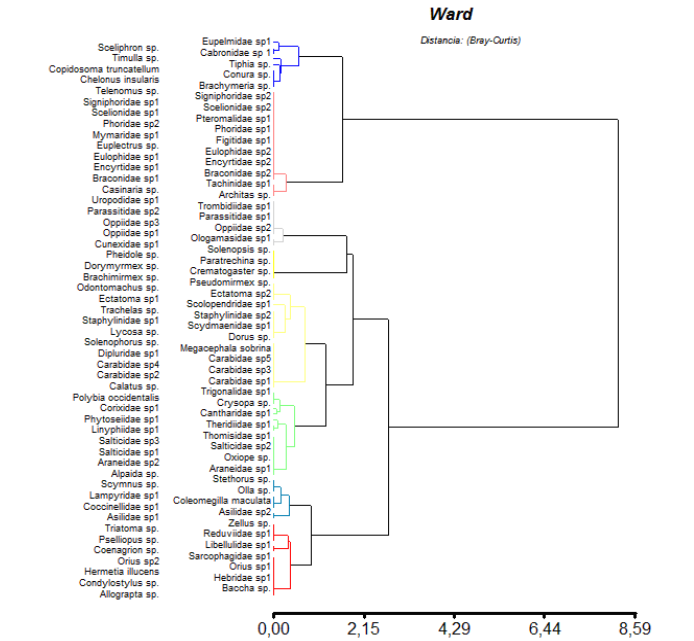
Al comparar la localidad de San Pelayo con relación a los grupos funcionales, este expreso un comportamiento un poco diferenciado en el lote 6 del cultivo convencional, agrupando cerca de 29 familias de artrópodos depredadores y 19 familias de parasitoides, aunque este mismo comportamiento no se expreso para el lote 2 de la misma variedad en la localidad de Cereté, agrupando solo 28 familias de depredadores y 18 familias de parasitoides (Figura 4 a).
Por su parte los lotes 3 y 4 (Cereté) de variedad transgenica con relación a las familias de depredadores estuvieron representados con 28 y 29 taxones respectivamente; además las familias de parasitoides se mantuvo en 18 para cada lote, siendo estos mas reducidos con relación a los convencionales, en una (1) familia de parasitoides. De igual manera los lotes 7 y 8 de variedad transgenica para la localidad de San Pelayo, presentaron un comportamiento diferenciado con respecto a los lotes transgenicos de la localidad de Cereté, agrupando 29 y 32 familias predadoras, respectivamente. Asi mismo, los lotes 7 y 8 de variedad transgenica fueron más representativos en cuanto a las familias parasitoides con 20 y 18 familias (Figura 4 b).
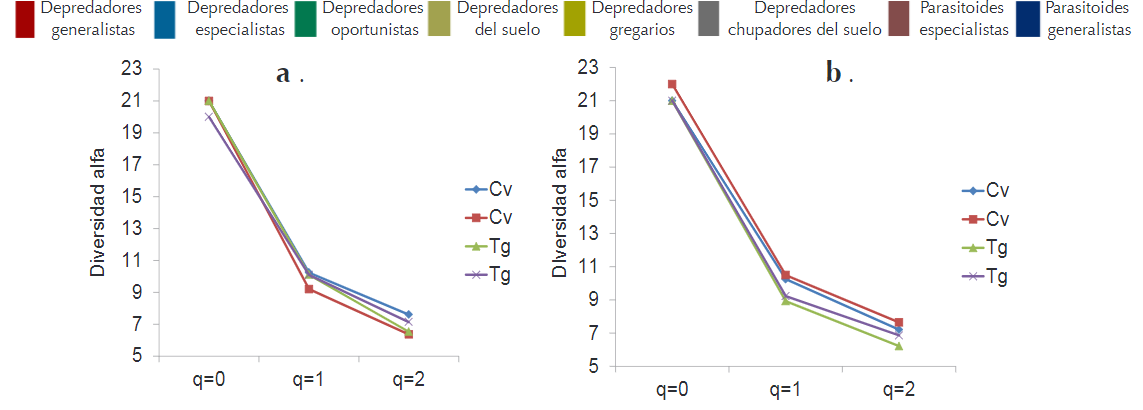
El análisis de diversidad alfa empleando grupos funcionales reveló que no hubo diferencias entre cultivos de maíz convencionales y cultivos que usan tecnología Bt. La diversidad de los grupos funcionales para la clasificación de todos los artrópodos sigue la misma tendencia en ambas localidades y eventos (Convencional-Transgénico); al analizar la riqueza de grupos funcionales por medio de la diversidad alfa verdadera 0D, se obtuvo en ambos localidades los ocho (8) grupos funcionales; en la diversidad verdadera tipo 1D que incluye el valor efectivos en el cultivo convencional (1D = 6,76) comparado con el transgénico (1D = 6,83).
Al expresar las equivalencias, se puede concluir que la similitud entre los cultivos se encuentra en un rango entre el 96 y el 98% teniendo en cuenta los valores obtenidos en los diferentes perfiles de diversidad, para el orden 2D se obtuvieron valores de 6,17 para el cultivo convencional y de 6,21 para el cultivo transgénico; estos resultados indican que no se observó diferencias significativas con relación a los tres perfiles de diversidad entre los cultivos convencional y transgénico para los grupos funcionles de artrópodos asociados (Figura 5).
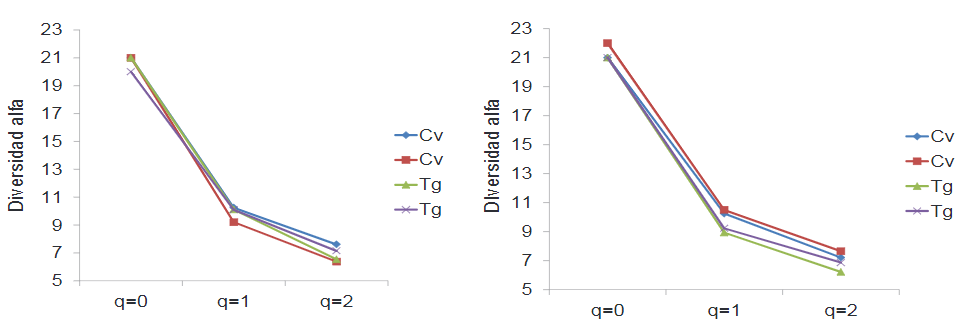
El análisis de diversidad alfa empleando grupos funcionales de insectos benéficos reveló que no hubo diferencias entre cultivos convencionales y cultivos que usan tecnología Bt. Con relación al grado de recambio de los grupos funcionales de beneficos evaluados mediante el número efectivo de unidades entre los tipos de cultivo con relación a los lotes mostró valores muy cercanos a 1, estos resultados indican que no existe diferencia entre los grupos funcionales de beneficos en los diferentes cultivos.
Al analizar la comunidad de artrópodos presentes para los dos tipos de cultivo convencional y transgénico; mediante las curvas de rango-abundancia, se observa que la pendiente indica una tendencia entre los grupos funcionales, las curvas estuvieron dominadas por los más comunes para el agroecosistema maíz (Figura 6a) .
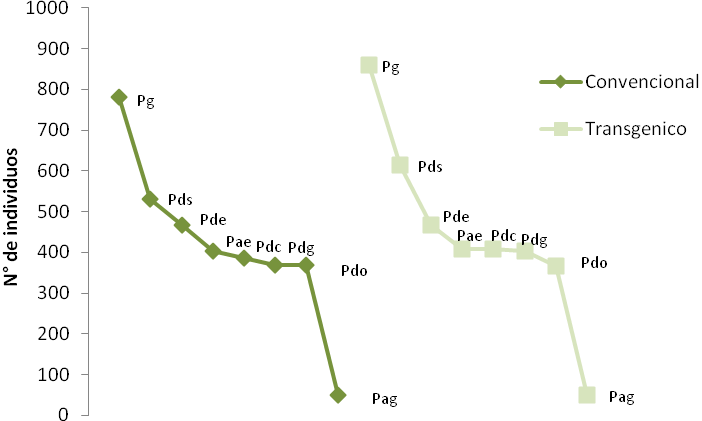
Este comportamiento se puede atribuir a diferentes factores como el comportamiento entre los que se considera a los grupos que de manera natural son abundantes, tales como los depredadores gregarios, depredadores del suelo y depredadores especialistas, que por su distribución presentan algún efecto en cuanto a las capturas como es el caso de Brachymirmex sp., Dorymyrmex sp., Paratrechina sp., Solenopsis sp., Ectatoma sp1, Solenophorus sp., Stethorus sp. y Olla sp. Uno de los grupos más abundantes entre los artrópodos fueron las hormigas (Brachymyrmex sp. y Solenopsis sp.).
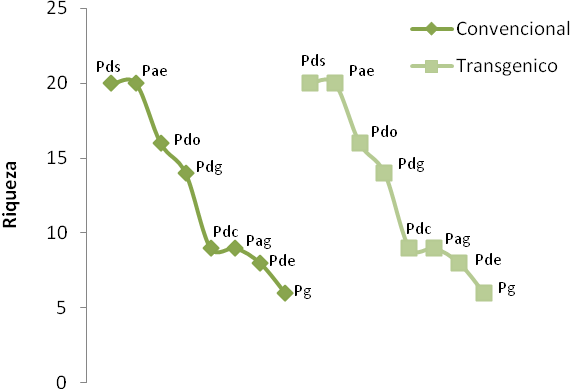
Cuando se analiza la riqueza de los diferentes grupos funcionales en ambos cultivos se puede ver que los más representativos fueron los depredadores del suelo, con especies como Trachela sp., Lycosa sp., Megacephalasobrina, Dorus sp., Ectatoma sp1, Solenophorus sp., Calatus sp., Odontomachus sp., y Pseudomirmex sp.; seguido de los parasitoides especialistas con especies como Archita sp., Euplectrus sp., Casinaria sp., Telenomus sp.; y los depredadores oportunistas, con especies como Alpaida sp., Oxiope sp., Polybia occidentalis y Crysopa sp. (Figura 6b).
CONCLUSIONES
Durante la fase de muestreo de la artropofauna benéfica en cultivos de maíz transgénico y convencional, se colectaron un total de 6,93 individuos, registrados en 102 taxones discriminados en 6 especies identificadas, 42 géneros y 54 familias. Para el cultivo transgénico se registró la mayor abundancia con 3577 individuos, equivalentes a un 51,60% de la representatividad total del muestreo; y para el cultivo convencional 3355 individuos, siendo este un 48,39% de los especímenes colectados.
Del total recolectado en los diferentes sistemas de trampeos se pudo evidenciar que la mayor representatividad de individuos estuvo marcada por la clase Insecta, con un 76,47%, en comparación con las clases Arachnida y Myriapoda donde la proporción de capturas fue de 22,55% y 0,98%. De los taxones de artrópodos benéficos encontrados, su representatividad según ordenes taxonómicos registró que el orden Hymenoptera fue el más abundante, representando el mayor número de individuos en el cultivo convencional (CC) con el 35,14% y para el cultivo transgénico (CT) con el 34,27%, seguido por el Orden Coleóptera con 24,83% (CC) y 24,13% (CT), luego el Orden Diptera con 12,02% (CT) y 11,59% (CC), finalmente el Orden Araneae registró un 8,05% (CT) y 7,72% (CC); siendo estos los ordenes más representativos.
La clasifición de los grupos funcionales en términos de funcionalidad, el 20% de los taxones evaluados fueron depredadores del suelo, parasitoides especialistas 20%, depredadores oportunistas 16%, depredadores generalistas 14%, 9% depredadores chupadores del suelo, parasitoides generalistas 9%, depredadores del suelo, 8% depredadores especialistas y 6% depredadores gregarios. En cuanto al análisis de diversidad verdadera alfa y beta estos indicadores mostraron valores que no difieren significativamente entre los dos tipos de cultivo, lo que indica que para este estudio la diversidad de la entomofauna benéfica en cultivos de maíz convencional y transgénico no es diferente.
REFERENCIAS
Benamú, M. 2010. Composición y estructura de la comunidad de arañas en el sistema de cultivo de soja transgénica. Tesis de Doctorado, Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, Argentina pp. 120.
Berry, N., Wratten, S., McErlich, A. y Frampton, C. 1996. Abundance and diversity of beneficial arthropods in conventional and "organic" carrot crops in New Zealand. New Zealand Journal of Crop and Horticultural Science 24: 307-313.
Borror, D. and White, R. 1998. A field guide to insects: America north of Mexico (Vol. 19). Houghton Mifflin Harcourt.
Casanoves, F., Pla, L. y Di Renzo, J. 2011. Valoración y análisis de la diversidad funcional y su relación con los servicios ecosistémicos. Turrialba, CR. CATIE. 84pp.
Chao, C. and Jost, L. 2012. Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology, 9:2533-2547.
Chaves, D., Martins, S., Maruccib R., De Carvalho, A., Matoso, M. and Magid, J. 2016. Does Bt maize cultivation affect the non-target insect community in the agro ecosystem?. Revista Brasileira de Entomologia 60; pp. 82–93.
Conner, A., Glare, T., Nap, J. 2003. The release of genetically modified crops into the environment - Part II. Overview of ecological risk assessment. The Plant Journal 33: 19–46.
Corpoica. 2012. Aproximación metodológica del proyecto Lac biosafety para evaluar efectos sobre especies no objetivo: Caso del maíz Bt. pp 94.
Dively, G. 2005. Impact of transgenic VIP3A Cry1Ab Lepidopteran-resistant fieldcorn on the nontarget arthropod community. Environ. Entomol. 34, 1267–1291.
Feinsinger, P. 2003. El diseño de estudios de campo para la conservación de la biodiversidad. FAN (Fundación Amigos de la Naturaleza), Santa Cruz de la Sierra, Bolivia. 242 p.
Fernández, F. y Sharkey, J. (eds.). 2006. Introducción a los Hymenoptera de la Región Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia, Bogotá D. C., xxx + 894 pp.
Greenstone, M. 1999. Spider predation: How and why we study it. Journal Arachnology. 27: 333-342.
Hilbeck, A., Moar, W., Pusztai-Carey, M., Filippini, A. and Bigler, F. 1999. Prey-mediated effects of Cry1Ab toxin and protoxin and Cry2A protoxin on the predator Chrysoperla carnea. Entomol. Exp. Appl. 91: 305–316.
Jost, L. 2006. Entropy and diversity. Oikos, 113:363-375.
Lobos, E. 2003. Evaluación de la fauna benéfica en cultivos de algodón convencional y transgénicos con expresión de la toxina del Bacillus thuringiensis. INDEAS-Facultad de Agronomia y Agroindustrias-UNSE. Av. Belgrano 1912- 4200 Santiago del Estero- Argentina.
Magurran, A. 1998. Ecological biodiversity and its measurement.Princenton University Press, New Jersey. 179 p.
Marvier, M., McCreedy, C., Regetz, J. and Kareiva, P. 2007. A meta-analysis of effects of Bt cotton and maize on nontarget invertebrates. Science 316: 1475–1477.
Meissle, M. and Romeis, J. 2012. No accumulation of Bt protein in Phylloneta impressa (Araneae: Theridiidae) and other arthropods in Bt maize. Environ. Entomol. 41,1037–1042.
Moreno, C., Barragán, F., Pineda, E. and Pavón, N. 2011. Reanalyzing alpha diversity: alternatives to understand and compare information about ecological communities.
Nájera, R. y Souza, B. 2010. “Insectos benéficos. Guía para su identificación”. Edición del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) y la Universidad Federal de Lavras (UFLA), Minas Gerais, Brasil. Noviembre.
Naranjo S. 2005. Long-term assessment of the effects of transgenic Bt cotton on the function of the natural enemy community. Environmental Entomology 34: 1211–1223.
O’Callaghan, M., Glare, T., Burgess, E. and Malone, L. 2005. Effects of plantsgenetically modified for insect resistance on non-target organisms. Annu. Rev.Entomol. 50, 271–292.
Pérez, G., Tamajón, R., Aldebis, H. y Vargas O. 2009. Comunidad de arañas en cultivos de algodón ecológico en el sur de España. Rev. Colom. Entomol. 35: 168-172.
Riechert, S. and Lawrence, K. 1997. Test for predation effects of single versus multiple species of generalist predators: Spiders and their insect prey. Entomology Exp. Applic. 84: 147-155.
Rohlf, F. and Sokal, R. 1981. Biometry: the principles and practices of statistics in biological research. 2nd Ed., W.H. Freeman, San Francisco. pp. 321–371
Romeis, J., Meissle, M., Naranjo, S., Li, Y. and Bigler, F. 2014. The end of a myth – Bt(Cry1Ab) maize does not harm green lacewings. Front Plant Sci 5, 1–10.
Schuler, T., Potting, R., Denholm, I. and Poppy, G. 1999. Parasitoid behavior andBt plants. Nature 400, 825–826.
Triplehorn, C. and Johnson, N. 2005. Borror and DeLong's Introduction to the Study of Insects. Belmont, CA: Thomson Brooks/Cole.
White, J. and Andow, D. 2005. Host–parasitoid interactions in a transgeniclandscape: spatial proximity effects of host density. Environ. Entomol. 34,1493–1500.