

ENDOPARÁSITOS EN AVES RESIDENTES Y MIGRATORIAS DE PUNTASANTA BÁRBARA,PARQUE NACIONAL DARIEN, PANAMÁ
(Endoparasites in resident and migratory birds of Punta Santa Barbara at Darien National Park, Panama)
Revista Colón Ciencias, Tecnología y Negocios
Universidad de Panamá, Panamá
ISSN-e: 2313-7819
Periodicidad: Semestral
vol. 5, núm. 1, 2018
Recepción: 03 Noviembre 2017
Aprobación: 23 Diciembre 2017

Resumen: Con el objetivo de determinar la presencia y prevalencia de parásitos sanguíneos en aves residentes y migratorias en Punta Santa Bárbara, Parque Nacional Darién, se colectaron 271 muestras de sangre extraídas de 126 individuos de aves de 43 especies. Con un total de 24 frotis o 19.05% de las muestras positivas para algún tipo de parásito sanguíneo, se determinó que el más común de estos parásitos encontrados era el Haemoproteus (11.90%), Plasmodium (5.56%), seguido de Leucocytozoon (4.76%) y microfilarias pertenecientes a los helmintos con (0.79%) de prevalencia. Mediante el índice de Shannon-Wiener se determinó que la diversidad de parásitos en época lluviosa es similar a la registrada en la época seca. Mediante una prueba de Ji cuadrado, se determinó que Haemoproteus sp., es el parásito con mayor frecuencia en las muestras positivas, mientras que las microfilarias se registran con menor frecuencia. Se evaluó la frecuencia de aves parasitadas y no parasitadas de acuerdo a la masa del individuo mediante una prueba Ji cuadrado, encontrando para este estudio una diferencia significativa en el número de aves parasitadas de acuerdo a la masa del individuo, aves con parásitos presentan mayor peso. Este estudio es el primero en tema de parasitología para las aves de la Provincia del Darién, por lo tanto, todo lo que aquí reportamos es nuevo para este lado del país. Hasta el momento sólo hay 4 estudios previos de parásitos sanguíneos en aves para todo Panamá.
Palabras clave: Haemoproteus, malaria aviar, parásitos sanguíneos, paseriformes, Plasmodium, prevalencia.
Abstract: In order to determine the presence and prevalence of blood parasites in resident and migratory birds in Punta Santa Bárbara, Darién National Park, 271 blood samples taken from 126 birds of 43 species were collected. With a total of 24 smears or 19.05% of positive samples for some type of blood parasite, it was determined that the most common of these parasites found was Haemoproteus (11.90%), Plasmodium (5.56%), followed by Leucocytozoon (4.76%) and microfilariae belonging to helminths with (0.79%) prevalence. Using the Shannon-Wiener index, it was determined that the diversity of parasites in the rainy season is similar to that recorded in the dry season. Using a Chi-square test, it was determined that Haemoproteus sp., Is the parasite most frequently in positive samples, while microfilariae are recorded less frequently. The frequency of parasitized and non-parasitized birds was evaluated according to the mass of the individual by means of a Chi-square test, finding for this study a significant difference in the number of birds parasitized according to the mass of the individual, birds with parasites have greater weight This study is the first on parasitology for the birds of the province of Darien, therefore, everything that we report here is new for this side of the country. So far there are only 4 previous studies of blood parasites in birds for all of Panama.
Keywords: Haemoproteus, Avian Malaria, blood parasites, passerines, Plasmodium, prevalence.
INTRODUCCIÓN
La importancia de los parásitos y los patógenos en el decline de las poblaciones de especies silvestres está siendo reconocido recientemente (McCallum y Dobson, 1995). Entre los numerosos problemas de sanidad que afectan a las aves silvestres, las enfermedades parasitarias se destacan como uno de los más frecuentes, y los efectos que producen varían de infecciones subclínicas hasta la muerte (Di Fabbio J., 1996). Además, estas infecciones interfieren en el comportamiento y en el desempeño reproductivo de estas aves. Las aves silvestres son hospederos de una gran variedad de parásitos, pero existen pocos trabajos sobre las especies que atacan estos animales, y los que hay se refieren a grupos reducidos de aves (Figueiroa, et al., 2002).
Por otro lado, el análisis de muestras de sangre de las aves residentes y migratorias para determinar la presencia de malaria aviar está siendo utilizado en los últimos años en diferentes países. Estudios realizados en las islas Galápagos han dado resultados agradables al demostrar la
ausencia de malaria aviar en sus aves, sin embargo, han registrado en todas las muestras de palomas (Zenaida galapagoensis), la presencia de otro parásito sanguíneo Haemoproteus sp. Este parásito parece de amplia distribución en el archipiélago en estas especies y probablemente es una especie nativa, no introducida. Aparentemente no causa problemas serios en la salud de las palomas (De La Puente, et al. 2010).
Haemoproteus sp., son parásitos comunes transmitidos por artrópodos a la sangre de muchas especies de aves silvestres. Aunque el impacto de estas infecciones en las aves Paseriformes es potencialmente grande (Van Riper, et al., 1986; Atkinson y Van Riper, 1991), poco se sabe de los efectos de los parásitos en la sangre, ya sea en el individuo o a nivel de población. Los estudios comparativos sugieren que las infecciones por haematozoa tienen poco efecto debilitante en el ave (Ashford, 1971; Bennett, et al., 1988), sin embargo, tales infecciones pueden contribuir a la regulación de las poblaciones de manera sutil.
Los Hemoparásitos que han sido reconocidos en la sangre de aves incluyen: Atoxoplasma sp., Babesia sp., Haemoproteus sp., Hepatozoon sp., Leucocytozoon sp., Trypanosoma sp., Plasmodium sp., y las microfilarias que pertenecen al grupo de Nematodos (Clark, et al. 2009).
El Paludismo aviar es responsabilidad de los géneros Plasmodium, Haemoproteus y Leucocytozoon. Desde el punto de vista histórico-veterinario, recordaremos que el estudio de estos padecimientos aviares dio la clave para el conocimiento de la malaria humana.
La prevalencia de Hemoparásitos ha sido investigada en muchas especies de aves a lo largo de Europa y Norte América, sin embargo, la información para Centro y Sur América es escasa (Leppert, et al., 2004).
Las características hematológicas, en materia de salud, no se han documentado para la gran mayoría de especies de aves. Por otra parte, en la mayoría de los casos, el impacto que la interacción de factores fisiológicos (como la edad, el sexo, la reproducción, la temporada, la alimentación, el hábitat y la migración) y factores patológicos (como las enfermedades infecciosas) pueden tener sobre las características hematológicas de las aves, no se han resuelto por completo (Clark, et al., 2009).
Este estudio busca determinar la presencia de parásitos protozoarios sanguíneos en aves migratorias y residentes de Punta Santa Bárbara, Parque Nacional Darién, Panamá, dada la importancia de este lugar como punto migratorio de aves neotropicales y donde habitan muchas especies residentes.
METODOLOGÍA
Área de Estudio
El estudio se realizó en los bosques caducifolio y semicaducifolio localizado en el sector de Garachiné, Corregimiento de Garachiné, Distrito de Chepigana, Provincia de Darién. Este sector cuenta con una temperatura máxima de 39.8°C con una precipitación media anual de 1304.4 mm (ETESA, 2014).
La Finca Lay cuenta con 80 hectáreas de las cuales 60 hectáreas están ocupadas con prácticas de ganadería extensiva, entre otros usos (Figura 1). La topografía es 80% ondulada y 20% ligeramente plana, con pendientes con rangos entre 15° y 30°. La finca está limitada en recurso hídrico en la época seca, cuando pierde el 90% del cauce del río, quedando solamente un pequeño manantial como reservorio. En general, estas fuentes de agua están bordeadas por un bosque de galería muy escaso y fragmentado. En cuanto a la cobertura boscosa, la finca comprende y colinda con parches de bosques, rastrojos y el bosque de galería intervenido, que representan el principal hábitat de la fauna silvestre.
Captura de Aves
Para la captura de las aves se utilizaron 10 redes de niebla (12,0m x 2, 6m y ojo de malla de 36 mm) con cuatro bolsas, color negro y de nylon (Ralph et al., 1996) (Figura 2). Las redes estuvieron ubicadas a lo largo de un transecto que cruzaba la estación y estaban separados al menos por 150m. Cada sitio estaba identificado por un número exclusivo (de dos dígitos como máximo). Las redes estuvieron abiertas durante 10 a 11 horas por día (entre 06:00 a.m. a 5:00 p.m.). El esfuerzo de muestreo fue de 600h / (10) redes / mes que comprendió un periodo de 4 meses; es decir, una gira por mes a la Finca Lay durante 3 noches y 4 días.
Cada individuo capturado fue identificado hasta especie y se determinó la edad y el sexo de los individuos capturados en la medida de lo posible. El sistema de clasificación de edades presentado en este estudio está basado en el utilizado por el Bird Banding Laboratory del U. S. Fish and Wildlife Service (Estados Unidos) y la Bird Banding Office del Canadian Wildlife Service (Canadá) (CWS y USFWS, 1991).
Para verificar si la masa corporal se veía afectada por la presencia o ausencia de parásitos se tomaron datos de medida de la cuerda alar y masa corporal (Pyle, 1997; www.birdpop.org).
Toma de muestras de sangre
Las muestras de sangre fueron colectadas utilizando agujas 26G 3/8 intradermal con las cuales se pinchaba suavemente la vena ulnar ubicada debajo del ala del animal (Figura 2), una vez se mostraba exposición de sangre se colocaba un capilar, con el cual se colectó la sangre y se colocó una pequeña gota del fluido en uno de los lados de un portaobjeto limpio, cerca de la orilla, entonces se tomó otro portaobjeto limpio y en un ángulo de 30 a 40 grados se hacía contacto con la gota de sangre y se extendía sobre la superficie del primer portaobjeto rápidamente y de forma uniforme, de tal manera que se formara una capa de sangre delgada para examen hematológico, con una buena “cola”. Se dejó secar al aire y se fijó con metanol (5%) durante tres a cinco minutos y se colocaba en un recipiente conteniendo silica gel.
Para teñir las muestras se utilizó la Técnica de Giemsa, donde se sumergieron las placas con los frotis en la solución de Giemsa durante 30 a 40 minutos. La tinción de Giemsa para hemoparásitos, es un método habitual para el examen de frotis sanguíneos y otro tipo de muestras biológicas. Ya teñidas las placas con dicha solución, se colocaron sobre papel toalla para dejarlos secar y luego lavadas con abundante agua destilada (Argumedo, 1997).
Finalmente, las aves fueron liberadas en el mismo sitio de captura después del procedimiento antes señalado.

Análisis de las muestras sanguíneas
Las placas fueron llevadas al Laboratorio de Microscopia Electrónica y Confocal del Instituto Smithsonian de Investigaciones Tropicales (STRI) en Ancón, edificio Tupper. Utilizamos un Microscopio Nikon ECLIPSE E600 con una cámara incorporada marca Nikon DS-RI1, un objetivo de 100X con apertura numérica de 1.30 y aceite de inmersión.
Para el diagnóstico de hemoparásitos se empleó el protocolo sugerido por Rodríguez y Matta, (2001), brevemente las muestras fueron examinadas, primero en baja magnificación (100x) por un periodo de diez minutos. Una vez finalizado este tiempo, se llevó a cabo el examen en mayor
aumento, en 1000X para la búsqueda de parásitos intracelulares por un período mínimo de 25 minutos. El cálculo del tiempo y campos observados en el laboratorio permiten sugerir un promedio de 200 a 220 campos observados en mayor aumento por lámina. Aquellas láminas que resultaron positivas fueron reexaminadas por un período de 10-20 minutos adicionales, para poder observar un mayor número de parásitos. Las formas parasitarias se fotografiaron.
Análisis Estadísticos
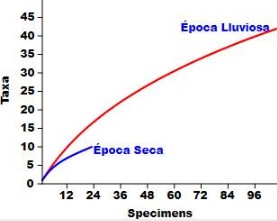
La prevalencia de infección fue calculada según Bush et al., (1997). Se realizó una curva de acumulación de especies tanto para aves como para parásitos y así conocer si el esfuerzo de muestreo era satisfactorio.
Para determinar si había o no diferencias en la diversidad de aves registradas entre la temporada de lluvia y la temporada seca se utilizó el índice de Shannon-Wiener y verificada mediante una prueba de Wilcoxon/Kruskal-Wallis (Suma de rangos). La diversidad de géneros de parásitos por estación del año, fue determinada mediante el índice de Shannon-Wiener.
Una prueba de Ji cuadrado nos ayudó a determinar la frecuencia de aparición de los parásitos encontrados. Mediante una prueba de Ji cuadrado, se evaluó si existía relación entre estación o época del año, edad, sexo, masa del individuo y la presencia o no de parásitos. Este análisis se verificó mediante un Análisis de Covarianza. El programa utilizado en estos análisis estadísticos fue Jump (JMP 11).
RESULTADOS
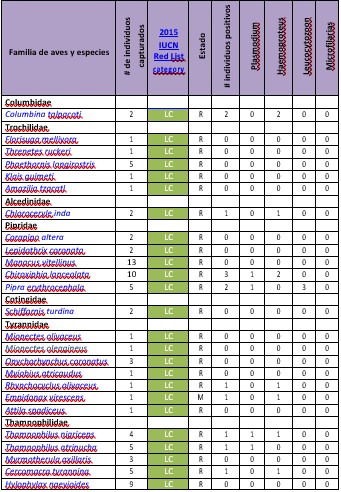
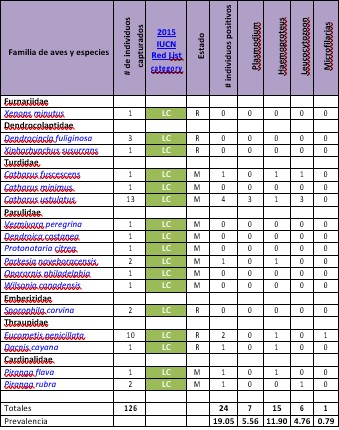
Al finalizar esta investigación, se registraron 43 especies de aves comprendidas en 14 familias pertenecientes a cuatro órdenes. De las cuales 31 eran especies residentes (que crían en Panamá) y 12 especies migratorias (que crían en Norteamérica).
Muestras analizadas
Se analizaron 271 frotis de sangre extraídas de unos 126 individuos de aves, obteniendo un total de 24 frotis o 19.05% de muestras positivas para algún tipo de parásito sanguíneo.
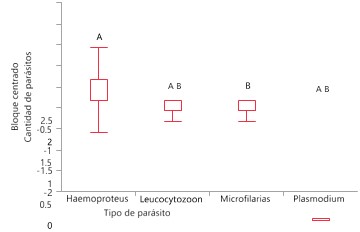
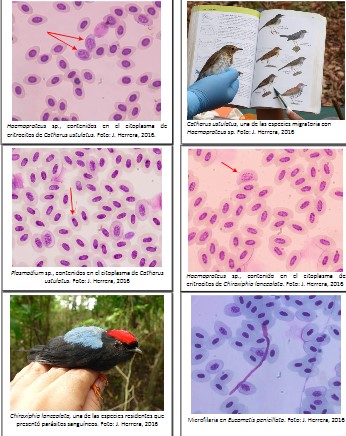
Se determinó que el más común de los parásitos encontrados fue el Haemoproteus sp., con un 11.90% de prevalencia, seguido de Plasmodium sp., con un 5.56% de prevalencia, Leucocytozoon sp., con un 4.76%, todos estos parásitos Apicomplexa de la Familia Plasmodiidae. Además, reportamos la presencia de microfilarias de la Familia Onchocercidae con 0.79% de prevalencia (Figura 3).
Diversidad de aves
Se estima que la provincia del Darién alberga al menos 670 especies de aves (ANAM, 2011), para nuestro estudio capturamos 43 especies, es decir, un 6.42% del total donde la curva de rarefacción de especies no logra el equilibrio.
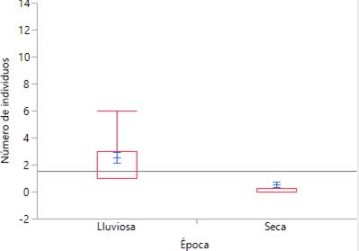
Para determinar si había o no diferencias en la diversidad de aves registradas entre la temporada de lluvia y la temporada seca utilizamos el índice de Shannon-Wiener (H´Época Lluviosa=3.362 ± 0.0091483; H´Época Seca = 2.043 ± 0.028896), la misma indicó que la diversidad de aves en época lluviosa es significativamente mayor que en la época seca (t= 6.7649; g.l.= 39.02; p = 4.50 x 10-
08) (Figura 4).
Verificamos los resultados anteriores utilizando una Prueba de Wilcoxon/Kruskal-Wallis (Suma de rangos) (Z= -6.36170, p <0.0001), demostrando de igual manera que existe una abundancia significativamente mayor de aves en la temporada lluviosa en comparación a la temporada seca.
| Estadísticos | Época Lluviosa | Época Seca |
| Taxa (S) | 42 | 10 |
| Individuals (N) | 106 | 23 |
| Dominance (D) | 0.04895 | 0.1569 |
| Simpson (1-D) | 0.9511 | 0.8431 |
| Shannon (H´) | 3.362 | 2.043 |
| Equitability (J) | 0.8995 | 0.8871 |
| Fisher alpha (α) | 25.71 | 6.733 |
Diversidad de parásitos
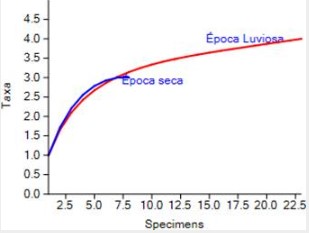
Se evaluó la diversidad de géneros de parásitos por estación del año mediante el índice de Shannon-Wiener (H´Época Lluviosa=1.1305± 0.01907; H´Época Seca =1.0397± 0.030639) indicando que la diversidad de parásitos en época lluviosa es similar a la registrada en la época seca (t= 0.40721; g.l.= 18.557; p = 0.68851) (Figura 5, Cuadro 1).
| Estadísticos | Época Lluviosa | Época Seca |
| Taxa (S) | 4 | 3 |
| Individuals (N) | 23 | 8 |
| Dominance (D) | 0.3724 | 0.375 |
| Simpson (1-D) | 0.6276 | 0.625 |
| Shannon (H´) | 1.131 | 1.04 |
| Equitability (J) | 0.8155 | 0.9464 |
| Fisher alpha (α) | 1.399 | 1.743 |
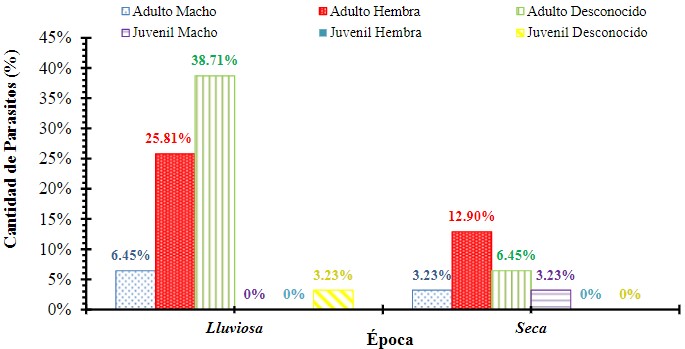
Una prueba de Ji cuadrado (X2= 13.9152, g.l.= 3, p = 0.0030) muestra que el parásito encontrado en mayor frecuencia fue Haemoproteus sp., mientras que el registrado en menor frecuencia fueron las microfilarias (Figura 6, Cuadro 2.
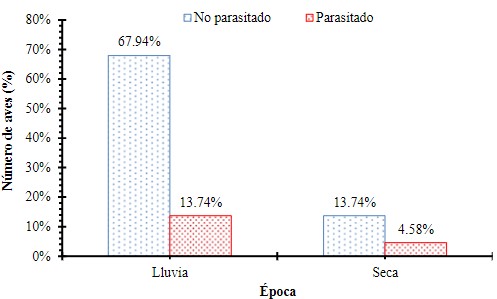
Aves parasitadas y no parasitadas por época del año
Se evaluó la frecuencia de aves parasitadas y no parasitadas y la estación o época del año mediante una Ji cuadrado (X2= 0.876, p = 0.3493), encontrando que no hay diferencias significativas en el número de aves parasitadas por época del año (Figura 7).
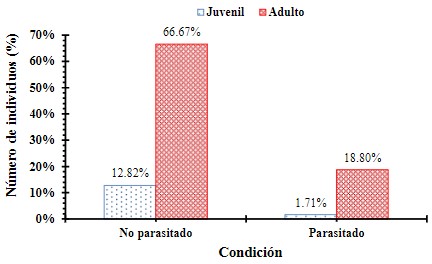
Aves parasitadas y no parasitadas de acuerdo a la edad
Se evaluó la frecuencia de aves parasitadas y no parasitadas de acuerdo a la edad del individuo mediante una Ji cuadrado (X2= 0.934, p = 0.3339), encontrando que no hay diferencias significativas en el número de aves parasitadas de acuerdo a la edad del individuo (Figura 8).
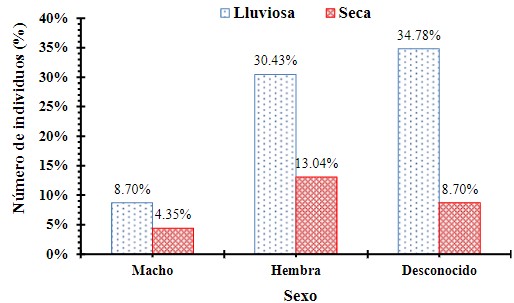
Aves parasitadas y no parasitadas de acuerdo al sexo
Se evaluó la frecuencia de aves parasitadas y no parasitadas de acuerdo al sexo del individuo mediante una Ji cuadrado (X2= 0.353, p = 0.8381), encontrando que no hay diferencias significativas en el número de aves parasitadas de acuerdo al sexo del individuo (Figura 9).
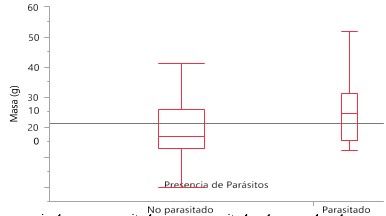
Aves parasitadas y no parasitadas de acuerdo a la masa
Se evaluó la frecuencia de aves parasitadas y no parasitadas de acuerdo a la masa del individuo mediante una Ji cuadrado (X2= 4.7874, g.l.= 1, p = 0.0287), encontrando que hay diferencias significativas en el número de aves parasitadas de acuerdo a la masa del individuo, aves con parásitos presentan mayor peso (Figura 10).
Un Análisis de Covarianza, nos indica que para este estudio no existe relación entre la edad, sexo, época del año y la especia de aves para la presencia de parásitos, lo cual indica que la presencia de estos en el ave es un evento dado al azar u la variable no está incluida dentro del análisis (Figura 11).
DISCUSIÓN
La prevalencia de parásitos en sangre de aves silvestres residentes y migratorias que habitan los bosques de Punta Santa Bárbara fue del 19.05%. Este valor es menor al reportado en la avifauna de regiones del Neártico, donde en promedios se obtiene hasta 37.0% de prevalencia (Greiner et al., 1975; White et al., 1978). Esta prevalencia también está por debajo de la prevalencia reportada en regiones vecinas como las islas del Caribe, específicamente en Puerto Rico, quienes reportan aproximadamente un 30.0% de positividad a hemoparásitos gracias a métodos moleculares con alta sensibilidad, esto les ha permitido brindar identificación de parásitos con linajes únicos en aves con infecciones de una intensidad muy baja (Fallon et al., 2003).
Sin embargo, nuestros resultados no son significativamente diferente de otros estudios realizados en regiones tropicales tales como en Colombia, donde Rodríguez y Matta (2001), reportan un 15.9%; Young et al., (1993), estudiaron aves silvestres en el área de conservación Monteverde, en donde muestrearon 479 especímenes, de los cuales 51 (10.65%) se encontraban infectados por hemoparásitos, también para Costa Rica Valkiûnas et al., en el 2004, reportan un 12.4%. de prevalencia.
Para Panamá es interesante notar que los únicos estudios realizados datan de hace aproximadamente 30 años, Galindo y Sousa, (1966) reportaron un 25.5% de prevalencia, mientras tanto Huff y Wetmore (1967) reportan un 17.49%, de igual manera Sousa y Hernán
(1982) reportan un 18.0% en aves estudiadas en diferentes sitios de Panamá, y más recientemente Herrera (2016) reporta 11.26% para el área del Caribe panameño, específicamente Punta Galeta, provincia de Colón. Al igual que en nuestro estudio, estas investigaciones reportaron la presencia de parásitos sanguíneos del grupo de Haemoproteus, Plasmodium, Leucocytozoon y Microfilarias.
Varias son las razones, además de la biología de las aves neotropicales, con la que se podría explicar el porcentaje de prevalencia encontrada en este trabajo. La relación directa entre la prevalencia del parásito y la temporada de lluvias, época de cría y las condiciones hormonales, son algunos factores que han sido reportado (Young et al., 1993). La prevalencia de hematozoarios en nuestras muestras de aves silvestres puede ser una mezcla de factores: uno es que la mayoría de las aves, (80.8%) fueron capturados durante la estación lluviosa, entre los meses de septiembre y principios de noviembre, durante la proliferación de los mosquitos y otros vectores; la segunda es que sólo el 15.2% de las aves estaban anidando, por lo tanto, hubo un menor número de individuos susceptibles a vectores que pican.
Para nuestro estudio Haemoproteus, con una prevalencia de 11.90%, fue el género más frecuente en las muestras positivas, tal como indica Atkinson y van Ripper (1991), que Haemoproteus es el género más encontrado, siendo registrado en el 67 por ciento de las especies de aves infectadas.
La prevalencia de Leucocytozoonosis para este estudio (4.76%), puede estar relacionada con los factores abióticos incluyendo condiciones ambientales favorables, especialmente la temperatura, las precipitaciones, humedad, y la presencia o ausencia de cuerpos de agua, todos estos elementos presentes en la finca Lay. Las corrientes de agua son necesarias para que los vectores, puedan reproducirse (Adler et al., 2004). Sin embargo, para nuestro estudio, cinco de los seis casos positivos se presentan en aves migratorias, tal como sugieren White et al., (1978); Greiner et al., (1975), que su presencia en el Neotrópico es en general asociada a aves migratorias. El caso positivo en aves residentes puede estar relacionado a la presencia de Simúlidos presentes en Panamá, tal como se indica en Herrera (2016) para los casos positivos en Punta Galeta, podrían estar relacionados con alguna de las 21 especies de Simúlidos reportados para Panamá.
En este estudio se reporta la presencia de una microfilaria del grupo de los helmintos en sólo un individuo de 126 aves examinadas, es decir, un 0.79%. Galindo y Sousa, (1966) reportaron para la comunidad de Almirante, Bocas del Toro, un 6.16% de prevalencia en 224 aves silvestres de un total de 3,634 aves examinadas. López et al., 2011, reportan por primera vez para Panamá Pelecitus helicinus en un gorrión piquinaraja (Arremon aurantiirostris, Emberizidae), en Aguas Claras, Provincia de Colón, encontraron 27 nemátodos en el tejido subcutáneo de la articulación tibio-tarsal y dedos. A pesar que P. helicinus tiene una distribución cosmopolita en las Américas, éste es el primer reporte de A. aurantiirostris como hospedero de este parásito y primera vez que se reporta el género Pelecitus para Panamá. La frecuencia de parasitismo que se determinó en A.
aurantiirostris (49 especímenes examinados) fue de solo 2.0%. Herrera (2016), reporta 0.43% de prevalencia en sólo un individuo de 231 aves examinadas para Punta Galeta, provincia de Colón.
Lo cierto es que hay poca información sobre el impacto de las filarias en las poblaciones de las aves silvestres, además este aspecto de su biología ha sido poco estudiado. Incluso con S. eurycerca, que es el patógeno mejor conocido entre todas las filarias de aves. La conclusión general es que "este parásito no ha recibido estudios suficientes para su completa gama de huéspedes, su frecuencia relativa de ocurrencia en diferentes especies, o su significado como factor de mortalidad de aves silvestres" (Cole, 1999). Como las microfilarias sólo pueden identificarse cuando se asocia con los gusanos adultos de las filarias y ningún adulto de filaria fue colectado para este estudio, estos parásitos no pueden ser identificados (Bennett et al., 1991).
Nuestro estudio indica que existe diferencias significativas entre la masa corporal de los individuos infectados con parásitos sanguíneos, aves con parásitos presentan mayor peso.
Estos resultados son contrarios a los presentados por Bennett et al., (1988), donde determinaban la influencia de los parásitos sanguíneos en la masa corporal de aves paseriformes y donde concluyeron que no había ningún tipo de interacción discernible de alguno de los géneros de parásitos sanguíneos en el peso corporal de las aves. De igual manera Ashford, (1971) no encontró correlación entre la presencia de hemoparásitos y la cantidad de grasa en las aves migratorias. Nuestro resultado puede estar relacionado con el aumento de masa corporal a medida que avanza la época migratoria tal como se señala en Saracco et al., (2008), ellos encontraron efectos significativos para la condición corporal la cual aumentó a lo largo de la temporada migratoria.
Para este estudio un análisis de covarianza nos indicó que no existe relación entre la edad, sexo, época del año y la especia de aves para la presencia de parásitos, lo cual indica que la presencia de estos en el ave es un evento dado al azar. Clark et al., (2009), indica que, en la mayoría de los casos, el impacto que la interacción de factores fisiológicos (como la edad, el sexo, la reproducción, la temporada, la alimentación, el hábitat y la migración) y factores patológicos (como las enfermedades infecciosas) pueden tener sobre las características hematológicas de las aves, no se han resuelto por completo, por lo tanto, las conclusiones se encuentran divididas.
La mayor prevalencia de parásitos sanguíneos para este estudio se reporta en las Familias Pipridae, con una prevalencia de 4.0% y Turdidae, con una prevalencia del 3.2%. Los miembros de la familia Pipridae realizan sus actividades muy encima del suelo (Ridgely y Gwynne, 2005), los que las mantiene muy cerca de vectores potenciales tales como ácaros, garrapatas, pulgas y otros artrópodos que se alimentan de la sangre de las aves. En el caso de Turdidae normalmente ocupan la cavidad de colonias o nidos (Hilty y Brown, 1986). En Panamá, aún no se han descrito los nidos de varias especies; aquellos que se conocen casi siempre se encuentran en hendeduras y grietas en los troncos y ramas de árboles, a menudo detrás de un trozo de corteza seca (Ridgely y
Gwynne, 2005). Estos nidos con frecuencia soportan grandes poblaciones de ácaros, garrapatas, pulgas y otros artrópodos que se alimentan de la sangre de las aves que ocupan estos nidos. Estos artrópodos son relativamente sedentarios, y puedan servir como vectores potenciales de estos hemoparásitos (Kirkpatrick y Smith, 1988; Bennett y Peirce, 1989).
Es importante mencionar que durante nuestro estudio no observamos aves con características tales como: anemias, letargo, anorexia, plumas dañadas, crestas pálidas, excrementos verdes, diarrea, y parálisis parcial o total, como menciona Garnham (1966), para aves infectadas con algún tipo de parásito sanguíneo.
Según Bennett et. al., (1981 y 1993) indican que hay muy pocos informes de la mortalidad causadas por parásitos sanguíneos en aves silvestres. En parte, esto se debe sin duda al hecho de que, mientras que las aves domésticas y de zoológicos son monitoreadas constantemente en condiciones en las que se ven fácilmente pájaros muertos, los cadáveres de aves pequeñas (o cualquier otro animal pequeño) se encuentran raramente en la naturaleza, ya que los animales carroñeros en la naturaleza eliminan rápidamente todos los cadáveres.
Los endoparásitos encontrados en las diferentes muestras no poseen riesgo a la salud humana, es decir, no son posibles causantes de antropozoonosis.
En cuanto a la metodología utilizada para la identificación de los parásitos, en la actualidad, parece aconsejable utilizar tanto técnicas moleculares y morfométricas tradicionales (microscopio), como se utilizó en este estudio y como lo ha sugerido Sehgal et al., (2006) y Martinsen et al., (2006).
Finalmente podemos decir que la interpretación de los resultados hematológicos es más eficaz cuando se conocen las características de una especie en particular.
Lamentablemente, estos hechos básicos no son conocidos para la mayoría de las especies de aves, lo que requiere la extrapolación de los conocimientos de las características de las especies de aves domésticas y que son relativamente pocos, limitados a especies consideradas importantes por razones económicas o por disposición de las aves o por la dificultad técnica en la captura de una población homogénea y significativa de las especies de aves (Clark et al., 2009).
CONCLUSIONES
La prevalencia de parásitos en sangre de aves silvestres residentes y migratorias que habitan los bosques semicaducifolio de Punta Santa Bárbara, provincia del Darién fue del 19.05%. Las Familias Pipridae, Tyrannidae, Parulidae y Thamnophilidae fueron las más capturadas en las redes de niebla. Catharus ustulatus, de la Familia Turdidae, es la especie migratoria con mayor
prevalencia de parásitos, 30.77%, mientras que de las especies residentes, Chiroxiphia lanceolata
de la Familia Pipridae, fue quien presentó una mayor prevalencia de parásitos en sangre 30.0%.
Por su parte, la mayor prevalencia de hemoparásitos se observa en Haemoproteus sp. con un 11.90%. En cuanto a las aves infectadas encontradas para este estudio, podemos indicar que estos endoparásitos no presentan riesgos para la salud de los seres humanos.
Basado en los resultados obtenidos, se recomienda realizar un inventario biológico de los posibles vectores (mosquitos, moscas, jejenes) que habitan y se reproducen en Punta Santa Bárbara, así como realizar estudios utilizando técnicas moleculares, PCR, a fin de conocer las especies de los géneros presentados en este estudio y aumentar la sensibilidad del diagnóstico parasitológico
Se propone aumentar la cantidad de muestra de aves para tratar de capturar una mayor cantidad y diversidad de parásitos además de realizar muestreo en otros sitios, parques y reservas forestales de todo el país, a fin de tener conocimiento general de la parasitología de las aves de Panamá así como estudios puntuales en parásitos tales como Microfilarias y Trypanosoma, ya que hay muy poca información de estos grupos.
ANEXOS
Agradecimientos
Al Grupo para la Educación y el Manejo Ambiental Sostenible (GEMAS), Fundación Natura, Fondo Darién, por la beca otorgada para realizar este proyecto. A Allys Lu M., y a la Sra. Ariadna, por todo el apoyo en logística y asesoramiento para realizar este proyecto. A los (as) asistentes de campo: Carol Gantes, Kenia Castañeda, Yamilka Fuentes y Efraín Sandoval. A nuestro personal de apoyo en campo, particularmente a la Sra. Ana Cecilia Tejeira, Ana María Tejeira. A los dueños de la Finca Lay, Evaristo Lay. Al Sr. Alejandro Gómez (Alejo) y Xavier (nuestros lancheros). A la Profesora Nivia Ríos MSc., por su apoyo en la preparación de los tintes y a Jacinto Pérez, por su colaboración en los análisis estadísticos.
REFERENCIAS BIBLIOGRÁFICAS
Autoridad Nacional del Ambiente (ANAM). (2011). Producción forestal sostenible y conservación con participación comunitarias en la Reserva Forestal de Chepigana de Darién. Evaluación ecológica rápida Reserva Forestal de Chepigana. 170 pp.
Adler, P. H., Currie, D. C. y Wood, D. M. (2004). The black flies (Simuliidae) of North America. Cornell University Press, Ithaca, NY.
Argumedo, R. L. (1997). Manual de técnicas para preparar y estudiar los parásitos de animales silvestres. A. G. T. Editor, S. A. Primera Edición. México. pp. 16
Ashford, R. W. (1971). Blood parasites and migratory fat at Lake Chad. Ibis 113: 100–101
Atkinson, C. T. y Van Riper III, C. (1991). Pathogenicity and epizootiology of avian haematozoa: Plasmodium, Leucocytozoon, and Haemoproteus. Bird–parasite interactions: ecology, evolution and behavior (ed. J. E. Loye & M. Zuk), pp. 19– 48. Oxford University Press.
Bennett, G. F., KucerA, J., Woodworth-Lynas, C. y Whiteway, M. (1981). Bibliography of the avian blood-inhabiting protozoa. Supplement 1. Memorial University of Newfoundland Occasional in Biology 4:1–33.
Bennett, G. F., J. R. Caines Y Bishop, M. A. (1988). Influence of blood parasites on body mass of passeriform birds. Journal of Wildlife Diseases 24: 339–343.
BENNETT, G.F. y PEIRCE, M. A. (1989). Hepatozoon parus n. sp., from the Paridae and redescription of H. atticorae (de Beaurepaire Aragão) Hoare, 1924 from the Hirundinidae. Canadian Journal of Zoology 67: 2859-2863.
BENNETT, G. F., GARVIN, M. y BATES, J. M. (1991). Avian Haematozoa from West-Central Bolivia. The Journal of Parasitology, Vol. 77, No. 2, pp. 207-211
Bennett, G. F., Peirce, M. A. y Ashford, R. W. (1993). Avian haematozoa: Mortality and pathogenicity. Journal of Natural History 27:993–1001.
Bush, A. O., Lafferty, K. D., Lotz, J. L. y Shostak, A. W. (1997). Parasitology meets ecology on its own terms: Margolis et al. revisited. Journal of Parasitology, vol. 83, pp. 575-583.
Canadian Wildlife Service and U.S. Fish and Wildlife Service (CWS-USFWS). (1991). North American bird banding. U.S. Department of Interior, Fish and Wildlife Service, Laurel, MD, E.U.A.; y Ottawa, Canada: Environment Canada, Canadian Wildlife Service.
Clark, P.; Boardman, W. y Raidal, S. (2009). Atlas of Clinical Avian Hematology. Wiley – Blackwell Publication. First Published. 184 pp.
Cole, R. A. (1999). Heartworm of swans and geese. Field Manual of Wildlife Diseases: General Field Procedures and Diseases of Birds. Information and Technology Report 1999-001. USGS National Wildlife Health Center, Biological Resources Division, Madison, WI, Chapter 31. Available at www.nwhc.usgs.gov/publications/field manual/chapter 31.pdf.
De Freitas, F., Bianque, M., De Oliveira, A., De Brito, D. y Cavalcanti, M. (2002). Parásitos gastrointestinales de aves silvestres en cautiverio en el estado de Pernambuco, Brasil. Parasitol. latinoam., enero vol.57, no.1-2, p.50-54.
De La Puente, J.M., Merino, S., Tomás, G., Moreno, J. Morales, J. Lobato, E., García-Fraile, S.C. y Belda, E.J. (2010). The blood parasite Haemoproteus reduces survival in a wild bird: a medication experiment. Biology Letters. doi:10.1098/rsbl.2010.0046.
Di Fabbio, J. (1996). Ectoparásitos en aves. Avicultura Industrial: 46-48.
EMPRESA DE TRANSMISIÓN ELÉCTRICA, S.A. (ETESA). (2014). Datos Históricos,
Fallon, S. M., Ricklefs, R. E., Swanson, B. L. y Bermingham, E. (2003). Detecting avian malaria: an improved polymerase chain reaction diagnostic. Journal of Parasitol. 89: 1044_1047.
Galindo, P. y Sousa, O. (1966). Blood Parasites of Birds from Almirante, Panama with ecological notes on the hosts. Revista Biología. (Universidad de Costa Rica) 14 (1): 27·46.
Garnham, P. C. (1966). Malaria parasites and other Haemosporidia. Blackwell University Press, New York.
GREINER, E.C., BENNETT, G.F., WHITE, E.M., y COOMBS, R.F. (1975). Distribution of the
Herrera, J. M. (2016). Detección de protozoarios en aves residentes y migratorias de los manglares y zonas boscosas de Punta Galeta – Colón, Panamá. República de Panama. Universidad de Panamá. 138 pp.
Hilty, S. L. y Brown, W. L. (1986). A guide to the birds of Colombia. Princeton University Press. Princeton.
Huff, C. G. y Wetmore, A. (1967). Blood Parasites of Birds collected in four successive years in Panama. Bull.Wildlife Disease Assoc. Vol. 3: 178 – 181.
Kirkpatrick, C.E. y Smith, T.B. (1988). Blood parasites of birds in Cameroon. Journal of Parasitology 74: 1009-1013.
Lagaggio, V. R. A., Carbonera, M A., y Flores, M L. (1996). Levantamento parasitario en aves silvestres da fauna riograndense. XV CONGRESSO PANAMERICANO DE CIENCIAS VETERINARIAS, Campo Grande, Mato Grosso do Sul, Brasil. p 80.
Leppert, L., Layman, S., Bragin, E., y Katzner, T. (2004). Suervey for Hemoparasites in imperial Eagles (Aquila heliacal), Stepp Eagles (Aquila nipalensis), and White – tailed Sea Eagles (Heliaeetus albicilla) from Kazakhstan.
López, O. G., Santos, A., Quintero, D., Aguilar, C. y Miller, M. J. (2011). Nuevo registro para Panamá de Pelecitus helicinus (Molin, 1860) (Nemátodos: Filarioidea: Onchocercidae) como parásito subcutáneo del ave Arremon aurantiirostris (Passeriformes: Emberizidae). Tecnociencia 2011, Vol. 13, N°1.
Martinsen, E. S., Paperna, I. y Schall, J. J. (2006). Morphological versus molecular identification of avian Haemosporidia: an exploration of three species concepts. Parasitology 133:279–288
Mccallum, H. y Dobson, A. (1995). Detecting disease and parasite threats to endangered species and ecosystems. Trends in Ecology and Evolution 10 (6): 190-194.
Pyle, P. (1997). Identification Guide to North American Birds, Part 1. Slate Creek Press, Bolinas, CA.
Ralph, C. J., Geupel, G. R., Pyle, P., Martin, T. E., De Sante, D. F. y Milá, B. (1996). Manual de métodos de campo para el monitoreo de aves terrestres. Pacific Southwest Research Station Albany, California. 51 p.
Ridgely, R. S. y Gwynne, J. A. (2005). Guía de las Aves de Panamá, Incluyendo Costa Rica, Nicaragua y Honduras. Primera edición en español. Sociedad Audubon de Panamá y Asociación Nacional para la Conservación de la Naturaleza, ANCON, Panamá. 614 p.
Rodríguez, O. y Matta, N. E. (2001). Blood parasites of Eastern plains from Colombia. Acta Biológica Colombiana. 96:1173-1176.
Saracco, J. F., Desante, D. F., Pyle, P., Morales, S., Alcántara, J. L. y Romo, C. (2008). Determinación de la calidad del hábitat de invierno para aves migratorias terrestres. Un reporte de cinco inviernos (2002-03 a 2006-07) del Programa de Monitoreo de Sobrevivencia Invernal (MoSI). 47 pp.
Sehgal, R. N. M., Valkiûnas, G., Iezhova, T. A. y Smith, T. B. (2006). Blood parasites of chickens in Uganda and Cameroon with molecular descriptions of Leucocytozoon schoutedeni and Trypanosoma gallinarum. Journal of Parasitology 92:1336–1343.
Sousa, O. E. y Herman, C. M. (1982). Blood parasites of birds from Chiriquí and Panama provinces in the Republic of Panama. Journal of Wildlife Diseases 18: 205–221.
Van Riper, C., Iii, S. G. Van Riper, y M. Laird. (1986). The epizootiology and ecological significance of malaria in Hawaiian land birds. Ecological Monographs 56: 327–344.
Valkiûnas, G., Iezhova, T. A., Brooks, D. R., Hanelt, B., Brant, S. V., Sutherlin, M. E. y Causey, D. (2004). Additional Observations on Blood Parasites of Birds in Costa Rica. Journal of Wildlife Diseases, 40(3), pp. 555–561.
White, E. M., Greiner, E. C., Bennett, G. F. y Herman, C. M. (1978). Distribution of haematozoa of Neotropical birds. Rev. Biol. Trop. 26:43-102. www.birdpop.org/aimaps.htm.
Young, B. E., Garvin, M. C. y McDonald, D. B. (1993). Blood parasites in birds from Monteverde, Costa Rica. Journal of Wildlife Diseases 29: 555– 560.

