ARTÍCULOS ORIGINALES
Estudio coproparasitario y ectoparasitario en alpacas (Vicugna pacos Linnaeus, 1758) de Apolobamba, con nuevos registros de Phthiraptera (Insecta) e Ixodidae (Acari), La Paz – Bolivia
Coproparasitologycal and ectoparasitologycal survey in alpaca (Vicugna pacos Linnaeus, 1758) from Apolobamba, with new records of Phthiraptera (Insecta) and Ixodidae (Acari), La Paz - Bolivia
Estudio coproparasitario y ectoparasitario en alpacas (Vicugna pacos Linnaeus, 1758) de Apolobamba, con nuevos registros de Phthiraptera (Insecta) e Ixodidae (Acari), La Paz – Bolivia
Journal of the Selva Andina Animal Science, vol. 1, núm. 2, 2014
Selva Andina Research Society
Recepción: 01 Enero 2014
Aprobación: 01 Diciembre 2014
Publicación: 01 Diciembre 2014
Resumen: Aunque las parasitosis en camélidos sudamericanos (CSA) pueden causar grandes pérdidas económicas en Bolivia, el conocimiento sobre los parásitos en estas especies es limitado. Con el objetivo de entregar antecedentes sobre la fauna parasitaria en alpacas del Área Natural de Manejo Integrado Apolobamba (ANMI Apolobamba), en febrero de 2006 fueron evaluadas 82 alpacas para determinar la presencia de ecto y endoparásitos y establecer algunas determinantes biológicas y ecológicas para la presencia y distribución de los parásitos. En 54 (98.2%) muestras fecales se observaron formas parasitarias correspondientes a coccidias, nematodos, cestodos y trematodos, observándose predominio (P<0.05) de nematodos del orden Strongylida y Capillaria spp., en alpacas adultas y juveniles respectivamente. De los 82 individuos revisados, 51 (62.2%) presentaron infestaciones provocadas por Bovicola breviceps, Microthoracius mazzai, M. praelongiceps, M. minor, Amblyomma parvitarsum y Sarcoptes scabiei var. aucheniae, con predominio (P<0.05) de los piojos M. praelongiceps en alpacas hembras. El registro de Bovicola breviceps es nuevo para Bolivia, y los ectoparásitos Microthoracius mazzai, M. praelongiceps, M. minor y Amblyomma parvitarsum constituyen los primeros registros para alpacas en Bolivia.
Palabras clave: Alpacas, presencia parasitaria, coccidia, Moniezia spp, Bovicola breviceps, Microthoracius spp, Amblyomma parvitarsum, Bolivia.
Abstract: Although parasites in South American camelids (SAC) can cause severe economic losses in Bolivia, a country with large populations of SAC, knowledge of these parasites in this species is limited. To obtain data on the parasitic fauna in alpacas from the Integrated Management Natural Area Apolobamba (ANMI Apolobamba), in February 2006 we evaluated 82 alpacas to determine the presence of ecto and endoparasites and investigate some biological and ecological drivers for the presence and distribution of parasites. In 54 (98.2%) fecal samples were positive to coccidia parasitic forms, nematodes, cestodes and trematodes. Significant prevalence (P<0.05) of nematodes of the order Strongylida and Capillaria spp. was found in adults and young alpacas respectively. From 82 individuals reviewed, 51 (62.2%) had infestations caused by Bovicola breviceps, Microthoracius mazzai, M. praelongiceps, M. minor, Amblyomma parvitarsum and Sarcoptes scabiei var. aucheniae, and significant prevalence (P <0.05) of lice M. praelongiceps was observed in females alpacas. This is the first registry of Bovicola breviceps in Bolivia, and the ectoparasites of Microthoracius mazzai, M. praelongiceps, M. minor and Amblyomma parvitarsum are the first records found in alpacas from Bolivia.
Keywords: Alpaca, parasitologycal presence, coccidia, Moniezia spp, Bovicola breviceps, Microthoracius spp, Amblyomma parvitarsum, Bolivia.
Introducción
La alpaca (Vicugna pacos Linnaeus 1758) es uno de los dos camélidos sudamericanos (CSAs) domesticados de gran importancia como fuente de fibra y carne para los habitantes altoandinos (Campero 2005). La alpaca se distribuye en tierras altas de la cordillera de los Andes, región conocida como altiplano (Macdonald 2001).
Dadas las condiciones de producción extensiva y semi intensiva de alpacas, las parasitosis constituyen un problema de alta trascendencia económica y según Leguía (1991) son el principal problema sanitario de estos CSAs. Diversos estudios parasitológicos en CSAs domésticos y silvestres han sido desarrollados dentro su distribución natural en países como Argentina (Arce de Hamity & Ortiz 2004, Beldomenico et al. 2003, Cafrune et al. 2001, Karesh et al. 1998, Sutton & Durette-Desset 1985), Chile (González-Acuña et al. 2004, González-Acuña et al. 2007, Rojas et al. 1993), Ecuador (Brolin-Schlanger 2003) y Perú (Cabrera 2002, Cicchino et al. 1998). En Bolivia se han realizado estudios coproparasitarios en CSAs domésticos (alpacas y llamas) en las localidades de Turco en Oruro, Patacamaya de La Paz, y en la Provincia Ayopaya de Cochabamba (Alandia 2003, Campero 1990, Pereira 1990), y de CSAs silvestres vicuñas (Vicugna vicugna Molina 1782) de Apolobamba, La Paz (Beltrán et al. 2011a). Además, se han llevado a cabo estudios de prevalencia de ectoparásitos de CSAs domésticos llamas (Lama glama Linnaeus 1758) en la Provincia de Ayopaya en Cochabamba, sin indicar especies (Alandia 2003). Hasta la fecha, los ectoparásitos de CSAs descritos en Bolivia, corresponden a los Phthiraptera Microthoracius mazzai (Werneck 1932) y Microthoracius praelon-giceps (Neumann 1909) en llamas (Neumann 1909, Werneck 1932) y M. mazzai y Microthoracius minor (Werneck 1935) en vicuñas (Beltrán-Saave-dra et al. 2011a) y el Ixodidae Amblyomma parvitarsum (Neumann 1901) en llamas (Dios 1917, Muñoz-Leal et al. 2013) y en vicuñas (Beltrán-Saavedra et al. 2011b, Mastropaolo et al. 2014), no habiendo a hasta la fecha reportes de Phthiraptera Bovicola breviceps (sin.= Damalinia breviceps) (Rudow 1866), además de no existir reportes en alpacas como hospedadores de Phthiraptera, y de Ixodidae A. parvitarsum en Bolivia.
El Área Natural de Manejo Integrado Apolobamba (ANMI Apolobamba) cuenta con 130000 cabezas de ganado de los cuales el 86% son alpacas (ARAUCARIA-SERNAP 2004), representando una de las regiones alpaqueras más importante de Bolivia.
El presente estudio tiene como objetivo entregar antecedentes sobre la fauna de parásitos internos y ectoparásitos presentes en alpacas de cuatro comunidades del ANMI Apolobamba, discutir sus implicancias sanitarias y zoonóticas.
Materiales y métodos
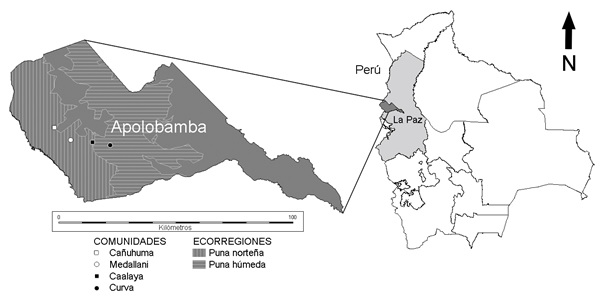
El ANMI Apolobamba se localiza al Nor-Oeste del Departamento de La Paz, Bolivia (68º30’-69º20’ E, 14º40’-15º10’S), en las provincias Bautista Saavedra y Franz Tamayo. Posee una extensión total de 4837.4 Km2 y un rango altitudinal de 800 a 6200 m. Tiene una posición fronteriza con la República del Perú y limita también al Norte con el Parque Nacional y ANMIN Madidi (ARAUCARIA-SERNAP 2004, SERNAP 2000). El área se incluye en las Provincias biogeográficas de Puna y Yungas (Morrone 2006) y en las ecorregiones de puna norteña, puna húmeda y yungas montañoso (Ibisch & Merida 2003).
En febrero de 2006 (época húmeda), en el Cantón Curva perteneciente a la provincia Bautista Saavedra, se evaluó la sanidad parasitaria de alpacas criadas por pastoreo libre en praderas nativas, realizando el estudio en las comunidades de Cañuhuma (15°1'50.61" S, 69°11'21.24" O) y Medallani (15°4'39.94" S, 69°7'26.89" O) localizadas en la ecorregión de puna norteña, y en las comunidades de Caalaya (15°5'7.62" S, 69°2'33.16" O) y Curva (15°5'48.36" S, 68°58'18.97" O) localizadas en la ecorregión de puna húmeda (Fig. 1), todas dentro de la Provincia biogeográfica de Puna (Morrone 2006). Las alpacas estudiadas cohabitaron en todas las comunidades con ovinos, y a excepción de la comunidad de Curva, con poblaciones de CSAs silvestres vicuñas.
Se evaluaron 82 alpacas de diferentes sexos (hembras= 50 y machos= 32) y edades (juveniles y adultos), colectando de estas 55 muestras fecales en tres comunidades, las que fueron analizadas en forma individual.
Las heces se recolectaron directamente del recto de los animales y fueron almacenadas en bolsas plásticas, codificadas y conservadas en formol 10% (Ueno & Gutierrez 1983). Posteriormente, se hizo el análisis coproparasitológico usando la técnica cualitativa de sedimentación modificada Niah (Ueno & Gutierrez 1983) y las técnicas cuantitativas de flotación por enriquecimiento de Gordon & Whitlock modificado con cámara McMaster (Ueno & Gutierrez 1983) a partir de 10 huevos por gramo de heces (H.P.G.) u ooquistes por gramo de heces (O.P.G.) (Instrumental, Pasteur®, Buenos Aires, Argentina) y la técnica modificada de Wisconsin con sacarosa a partir de 1 H.P.G. u O.P.G. (Bagley 1997). El criterio de cuantificación de cargas parasi-tarias (H.P.G. u O.P.G.) usado fue el recomendado por el fabricante de la cámara McMaster (leve<300, moderado=300-500 y elevado>500).
Para la identificación de protozoos (coccidias no esporuladas) y huevos de helmintos, se usaron criterios morfológicos y métricos descritos previamente (Fowler 1998, Leguía 1999, Soulsby 1987). Las medidas de ooquistes inmaduros, huevos de helmintos y ectoparásitos se reportaron en micras (µm) como media aritmética y desviación estándar (DS).
Para recolectar ectoparásitos, se procedió a revisar el pelaje y la piel de todo el cuerpo de cada individuo en ambos flancos durante aproximadamente 5 a 10 min. Los Phthiraptera e Ixodidae fueron extraídos con ayuda de pinzas. Las lesiones de sarna fueron raspadas en sus bordes, con ayuda de una hoja de bisturí hasta lograr un ligero sangrado. Todas las muestras recolectadas fueron almacenados en tubos individuales sin aditivo (Vacutainer® Corp., Becton Dickinson, Franklin Lakes., USA) codificados y conservados en etanol 70º. Los piojos fueron montados siguiendo la técnica descrita por Palma (1978) y posteriormente identificados (Cicchino et al. 1998, González-Acuña et al. 2004, González-Acuña et al. 2007). En el caso de las garrapatas, fueron identificadas según las descripciones morfológicas de Boero (1957), Guglielmone & Viñabal (1994) y Estrada-Peña et al. (2005). Todos los Phthiraptera e Ixodidae fueron compararon con especímenes de referencia del Departamento de Ciencias Pecuarias, Laboratorio de Zoología, Universidad de Concepción, Chile. Las muestras de raspajes de lesiones de sarna fueron preparadas e identificadas según criterios descritos previamente (Fowler 1998, Kraft & Schillinger 1998).
Estadísticas descriptivas fueron calculadas para estimar la prevalencia total (proporción de animales infectados e infestados). Para comparar la presencia de parásitos en dependencia de edad (adulto y juvenil) y sexo (macho y hembra) se aplicó la prueba Pearson X2 y cuando el número de muestras era limitado se aplicó el Test Exacto de Fisher con un grado de libertad y 95% de confiabilidad. Se usó el software estadístico SPSS V. 12.0 (Thrusfield 1990).
Los ejemplares de las especies de los ectoparásitos identificados, se localizan en la Sección de Invertebrados de la Colección Boliviana de Fauna (CBF) de la ciudad de La Paz - Bolivia, y en la Colección de garrapatas del Departamento de Ciencias Pecuarias, Laboratorio de Zoología, Universidad de Concepción, de la ciudad de Chillán - Chile.
Resultados
Coproparasitología. El 98.2% (Nr=54) de las muestras analizadas resultaron positivas a endoparásitos, de las cuales 42 (76.4%) fueron positivas a coccidias, 53 (96.4%) a nematodos, 9 (16.4%) a cestodos y una (1.8%) a trematodos. En 52 (94.6%) muestras se encontraron infecciones mixtas.
Entre las especies detectadas de coccidias predominó Eimeria punoensis (Nr= 37; %= 67.3), y entre los nematodos predominó Nematodirus sp. (Nr= 38; %= 69.1). Los cestodos se diferenciaron en Moniezia expansa (5.5%) y M. benedeni (10.9%), las que provinieron de las comunidades de Cañuhuma (Nr= 7) y Medallani (Nr= 2). La presencia del trematodo Fasciola sp., en alpacas (1.8%) fue baja y hallada en la comunidad de Caalaya de la ecorregión de puna húmeda (Tabla 1).
| Cañuhuma | Medallani | Caalaya | Total (Nr 55) | |||||
| Endoparásitos | (Nr 30) | (Nr 16) | (Nr 9) | |||||
| + | P (%) | + | P (%) | + | P (%) | + | P (%) | |
| Coccidias | ||||||||
| E. punoensis | 19 | 63.3 | 12 | 75 | 6 | 66.7 | 37 | 67.3 |
| E. alpacae | 3 | 10 | 6 | 37.5 | 0 | 0 | 9 | 16.4 |
| E. macusanensis | 3 | 10 | 2 | 12.5 | 2 | 22.2 | 7 | 12.7 |
| Nematodos | ||||||||
| Marshallagia sp. | 13 | 43.3 | 8 | 50 | 5 | 55.6 | 26 | 47.3 |
| Lamanema spp. | 3 | 10 | 0 | 0 | 0 | 0 | 3 | 5.5 |
| Nematodirus spp. | 21 | 70 | 11 | 68.8 | 6 | 66.7 | 38 | 69.1 |
| O. Strongylida | 14 | 46.7 | 11 | 68.8 | 4 | 44.4 | 29 | 52.7 |
| Capillaria sp. | 4 | 13.3 | 9 | 56.3 | 1 | 33.3 | 14 | 28.6 |
| Trichuris sp. | 11 | 36.7 | 8 | 50 | 1 | 11.1 | 20 | 36.4 |
| Cestodos | ||||||||
| M. expansa | 1 | 3.3 | 2 | 12.5 | 0 | 0 | 3 | 5.5 |
| M. benedeni | 6 | 20 | 0 | 0 | 0 | 0 | 6 | 10.9 |
| Trematodos | ||||||||
| Fasciola spp. | 0 | 0 | 0 | 0 | 1 | 11.1 | 1 | 1.8 |
Nr Muestras estudiadas; += Muestras positivas; P (%)= Porcentaje de población infectada.
La presencia de endoparásitos en las alpacas estudiadas de acuerdo al sexo del animal no presentó diferencias (P>0.05). Sin embargo, se observaron diferencias entre edades (P<0.05) para los nematodos del orden Strongylida (adultos= 21, %= 72.4; juveniles= 8, %= 30.8; Pearson X2= 7.94, P= 0.003) y Capillaria spp. (adultos= 3, %= 12; juveniles= 11, %= 45.8; Pearson X2= 5.31, P= 0.012) (Tabla 2).
| Endoparásitos | Sexo | Edad | ||||||||||
| H (Nr 35) | M (Nr 20) | PearX2 | Valor-P | A (Nr 29) | J (Nr 26) | PearX2 | Valor-P | |||||
| + | P (%) | + | P (%) | + | P (%) | + | P (%) | |||||
| Coccidias | ||||||||||||
| E. punoensis | 21 | 60 | 16 | 80 | 1.49 | 0.149 | 17 | 58.6 | 20 | 76.9 | 1.34 | 0.166 |
| E. alpacae | 4 | 11.4 | 5 | 25 | 0.87 | 0.261 | 4 | 13.8 | 5 | 19.2 | 0.32 | 0.721 |
| E. macusanensis | 3 | 8.6 | 4 | 20 | 0.65 | 0.242 | 2 | 6.9 | 5 | 19.2 | 0.93 | 0.336 |
| Nematodos | ||||||||||||
| Marshallagia sp. | 16 | 45.7 | 10 | 50 | 0.001 | 0.786 | 13 | 44.8 | 13 | 50 | 0.01 | 0.790 |
| Lamanema spp. | 2 | 5.7 | 1 | 5 | 0 | 1 | 1 | 3.4 | 2 | 7.7 | 0.009 | 0.598 |
| Nematodirus spp. | 22 | 62.9 | 16 | 80 | 1.04 | 0.235 | 17 | 58.6 | 21 | 80.8 | 2.20 | 0.089 |
| O. Strongylida | 20 | 57.1 | 9 | 45 | 0.35 | 0.415 | 21 | 72.4 | 8 | 30.8 | 7.94 | 0.003 |
| Capillaria sp. | 9 | 29 | 5 | 27.8 | 0 | 1 | 3 | 12 | 11 | 45.8 | 5.31 | 0.012 |
| Trichuris sp. | 14 | 40 | 6 | 30 | 0.20 | 0.565 | 13 | 44.8 | 7 | 26.9 | 1.20 | 0.262 |
| Cestodos | ||||||||||||
| M. expansa | 2 | 5.7 | 1 | 5 | 0 | 1 | 0 | 0 | 3 | 11.5 | 1.66 | 0.199 |
| M. benedeni | 3 | 8.6 | 3 | 15 | 0.08 | 0.657 | 1 | 3.4 | 5 | 19.2 | 2.08 | 0.090 |
| Trematodos | ||||||||||||
| Fasciola spp. | 1 | 2.9 | 0 | 0 | 0 | 1 | 1 | 3.4 | 0 | 0 | 0 | 1 |
= Hembras; M= Machos; A= Adultos (> de dos años); J= Juveniles (≤ a dos años); N= Población estudiada; += Población infestada; P (%)= Porcentaje de población infectada; PearX2= Pearson Chi cuadrado; Valor-P= Mediante el Test Exacto de Fisher.
En la tabla 3 se indican las medidas de ooquistes y huevos de los helmintos detectados en este trabajo y comparan con las descritas por otros autores (Beldomenico et al. 2003, Fowler 1998, Leguía 1999, Soulsby 1987, Sutton & Durette-Desset 1985).
| Hallazgos en este trabajo | Comparación con otras referencias bibliográficas | |||||
| Endoparásitos | Media aritmética (DS) | 1 | 2 | 3 | 4 | 5 |
| Coccidias | ||||||
| E. punoensis | 18.4 (2.4) X 17.5 (2.7) | - | - | 17-22 X 14-18 | 19.9 X 14.4 | - |
| E. alpacae | 25.2 (4.3) X 21.3 (3.9) | - | - | 22-26 X 18-21 | 24.1 X 19.6 | - |
| E. macusanensis | 88.4 (3.8) X 62.4 (1.7) | - | - | 81-107 X 61-80 | 93.6 X 67.4 | 81 X 58 |
| Nematodos | ||||||
| Marshallagia sp. | 171.1 (6.6) X 82.7 (5.6) | - | - | 178-217 X 78-100 | - | 181 X 81 |
| Lamanema spp. | 185 (6.3) X 83.3 (6.1) | 170 X 120 | - | 150-170 X 70-80 | 176 X 76 | - |
| Nematodirus spp. | 218.4 (19.7) X 110.3 (7.1) | - | - | 175-260 X 106-110 | 150-206 X 65-112 | 230 X 96 |
| O. Strongylida | 94,4 (7.3) X 55.4 (13.4) | - | - | 70-97 X 39-50 | - | - |
| Trichuris sp. | 76.7 (2.9) X 40.2 (6.4) | - | - | 70-80 X 30-42 | - | 79 X 32 |
| Capillaria sp | 64.8 (5.3) X 31.4 (1.4) | - | - | 45-50 X 22-25 | 45-52 X 21-30 | - |
| Cestodos | ||||||
| M. expansa | 66X 65 | - | 57 X 56 | 67 X 56 | 70 X 65 | - |
| M. benedeni | 60 X 50 | - | 75 | - | - | - |
| Trematodos | ||||||
| Fasciola spp. | 132.5 X 77.5 | - | 130-150 X 63-90 | 130-150 X 63-90 | 130-150 X 70-90 | - |
*Las medidas están expresadas en micrómetros; DS= Desviación estándar; Referencias bibliográficas: 1= Sutton & Durette-Desset 1985,
2= Soulsby 1987, 3= Fowler 1998, 4= Leguía, 1999, 5= Beldomenico et al. 2003.
Comparaciones de prevalencias de coccidias, nematodos, cestodos y trematodos en alpacas de la presente investigación con prevalencias obtenidas en estudios de alpacas, llamas y vicuñas de Bolivia (Cochabamba, La Paz y Oruro), Chile (Altiplano) y Perú (Cajamarca, Encañada y San Juan) por otros autores (Alandia 2003, Beltrán-Saavedra et al. 2011a, Cabrera 2002, Campero 1990, Pereira 1990, Rojas et al. 1993), son indicados en la tabla 4.
| Prevalencias registradas por otros autores | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | ||||
| Endoparásitos | Presencia en este estudio | Apolobamba | Turco | Patacamaya | Ayopaya | Cajamarca | Encañada | San Juan | Altiplano |
| La Paz | Oruro | Oruro | Cochabamba | Perú | Perú | Perú | Chile | ||
| Coccidias | 76.4% | 100%vi | 43.5%al ; 29.5%ll | - | 88%ll | 29.4%al | 25%al | 50%al | 8%al |
| Nematodos | 96.4% | 87.5%vi | 72%al ; 71%ll | 34%ll | 60%ll | - | - | - | - |
| Cestodos | 16.4% | 3.1%vi | 19%al ; 17%ll | - | 15%ll | - | - | - | 27%al |
| Trematodos | 1.8% | 0%vi | 39%al ; 0%ll | - | - | 0%al | 35.4%al | 30.1%al | - |
Referenciasas: 1= Beltrán-Saavedra et al. 2011a, 2= Campero 1990, 3= Pereira 1990, 4= Alandia 2003, 5= Cabrera 2002, 6= Rojas et al. 1993, al= Alpacas, ll= Llamas, vi=vicuñas.
Las cargas parasitarias registradas para coccidias, nematodos y cestodos se presentan en la tabla 5.
| Cañuhuma | Medallani | Caalaya | Total | |||||||||
| Endoparásitos | L | M | E | L | M | E | L | M | E | L | M | E |
| Coccidias | ||||||||||||
| E. punoensis | 17 | 1 | 0 | 11 | 1 | 0 | 6 | 1 | 0 | 34 | 3 | 0 |
| E. alpacae | 1 | 2 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 5 | 2 | 0 |
| Nematodos | ||||||||||||
| Marshallagia sp. | 13 | 0 | 0 | 8 | 0 | 0 | 5 | 0 | 0 | 26 | 0 | 0 |
| Lamanema spp. | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 |
| Nematodirus spp. | 20 | 1 | 0 | 11 | 0 | 0 | 6 | 0 | 0 | 37 | 1 | 0 |
| O. Strongylida | 14 | 0 | 0 | 11 | 0 | 0 | 4 | 0 | 0 | 29 | 0 | 0 |
| Capillaria sp. | 4 | 0 | 0 | 9 | 0 | 0 | 3 | 0 | 0 | 16 | 0 | 0 |
| Trichuris sp. | 11 | 0 | 0 | 8 | 0 | 0 | 1 | 0 | 0 | 20 | 0 | 0 |
| Cestodos | ||||||||||||
| M. expansa | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 1 |
| M. benedeni | 2 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 2 |
L= Grado leve; M= Grado moderado; E= Grado elevado.
Ectoparásitos. En 51 (62.2%) individuos se recolectó algún tipo de ectoparásito. En 48 alpacas (58.5%) se recolectaron piojos (Insecta: Phthira-ptera), de los cuales en 31 (37.8%) se encontraron Microthoracius mazzai, en 33 (40.2%) Microthoracius praelongiceps, en 14 (17.1%) Microthoracius minor y en 12 (14.6%) Bovicola breviceps. En ocho (9.8%) de las alpacas analizadas fueron recolectados Acari. Cuatro de estas alpacas (4.9%) presentaron ejemplares de Amblyomma parvitarsum (Acari: Ixodoidea) y en las otras cuatro (4.9%) se observó sarna que era causada por Sarcoptes scabiei var. Aucheniae. En 23 (45.1%) individuos se hallaron infestaciones simples y en 28 (55%) se detectaron infestaciones mixtas. El detalle de los hallazgos según localidad es presentado en la tabla 6.
| Cañuhuma | Medallani | Curva | Caalaya | Total | ||||||
| Ectoparásitos | (Nr 34) | (Nr 18) | (Nr 10) | (Nr 20) | (Nr 82) | |||||
| + | P (%) | + | P (%) | + | P (%) | + | P (%) | + | P (%) | |
| Phthiraptera | ||||||||||
| M. mazzai | 13 | 38.2 | 8 | 44.4 | 3 | 30 | 7 | 35 | 31 | 37.8 |
| M. praelongiceps | 20 | 58.8 | 5 | 27.8 | 0 | 0 | 8 | 40 | 33 | 40.2 |
| M. minor | 8 | 23.5 | 2 | 11.1 | 0 | 0 | 4 | 20 | 14 | 17.1 |
| Bovicola breviceps | 3 | 8.8 | 0 | 0 | 7 | 70 | 2 | 10 | 12 | 14.6 |
| Acari | ||||||||||
| A. parvitarsum | 1 | 2.9 | 3 | 16.7 | 0 | 0 | 0 | 0 | 4 | 4.9 |
| S. scabiei var. Aucheniae | 1 | 2.9 | 0 | 0 | 3 | 30 | 0 | 0 | 4 | 4.9 |
Nr Población revisada; += Población infestada; P (%)= Porcentaje de población infestada.
Las infestaciones halladas no presentaron diferencias entre edades (P>0.05), pero si se observaron diferencias (P<0.05) en las infestaciones por piojos Microthoracius praelongiceps entre sexos (Hembras= 25, %= 50; Machos= 8, %= 25; Pearson X2= 4.09, P= 0.037) (Tabla 7).
| Sexo | Edad | |||||||||||
| Ectoparásitos | H (Nr 50) | M (Nr 32) | PearX2 | Valor-P | A (Nr 42) | J (Nr 40) | PearX2 | Valor-P | ||||
| + | P (%) | + | P (%) | + | P (%) | + | P (%) | |||||
| Phthiraptera | ||||||||||||
| M. mazzai | 19 | 38 | 12 | 37.5 | 0 | 1 | 12 | 28.6 | 19 | 47.5 | 2.37 | 0.111 |
| M. praelongiceps | 25 | 50 | 8 | 25 | 4.09 | 0.037 | 15 | 35.7 | 18 | 45 | 0.39 | 0.500 |
| M. minor | 7 | 14 | 7 | 21.9 | 0.39 | 0.38 | 9 | 21.4 | 5 | 12.5 | 0.61 | 0.382 |
| Bovicola breviceps | 8 | 16 | 4 | 12.5 | 0.01 | 0.757 | 7 | 16.7 | 5 | 12.5 | 0.05 | 0.757 |
| Acari | ||||||||||||
| A. parvitarsum | 3 | 6 | 1 | 3.1 | 0 | 1 | 2 | 4.8 | 2 | 5 | 0 | 1 |
| S. scabiei var. Aucheniae | 3 | 6 | 1 | 3.1 | 0 | 1 | 1 | 2.4 | 3 | 7.5 | 0.32 | 0.353 |
H= Hembras; M= Machos; A= Adultos (> de dos años); J= Juveniles (≤ a dos años); Nr Población revisada; += Población infestada; P (%)= Porcentaje de población infestada; PearX2= Pearson Chi cuadrado; Valor-P= Mediante el Test Exacto de Fisher.
Discusión
Este estudio provee datos inéditos acerca del parasitismo en alpacas e identifica algunas determinantes como el sexo y la edad asociados a altas prevalencias de parásitos, efectos ecorregionales en la distribución de parásitos, e indicios de interacciones parasitarias entre especies en un escenario de sobrecarga animal. Se reporta por primera vez para Bolivia la presencia de B. breviceps, y además alpacas de Bolivia como nuevos hospedadores de M. mazzai, M. praelongiceps, M. minor y A. parvitarsum.
Coproparasitología. La mayor prevalencia observada en el presente estudio fue para nematodos (96.4%), porcentaje que es superior a las prevalencias reportadas en investigaciones realizadas en alpacas y llamas de Oruro (Campero 1990, Pereira 1990), llamas de Cochabamba (Alandia 2003) y vicuñas de Apolobamba - La Paz (Beltrán-Saavedra et al. 2011a), en Bolivia. Los altos porcentajes de individuos con nematodos (96.4%), posiblemente se deban a que en época de lluvias los parásitos del orden Strongylida (52.7%) tienen condiciones ambientales favorables para su desarrollo, sobrevivencia y transmisión de larvas infectivas (Leguía 1999).
Por otro lado, los nematodos Lamanema spp. (5.5%) y Nematodirus spp. (69.1%) encontrados en este trabajo, al tener la capacidad de eliminar huevos morulados que desarrollan larvas infectivas al momento de eclosionar por cambios térmicos ambientales y durante todo el año (Rojas et al. 1986), podrían ser una causa constante de infecciones en alpacas del ANMI Apolobamba.
La mayor presencia de Capillaria spp. (45.8%) fue observada en alpacas juveniles. Este hallazgo podría tener bases inmunes, ya que las alpacas menores a los dos años son más susceptibles a infecciones por nematodos debido a un sistema inmune inmaduro sin contar con previas exposiciones a estos patógenos (Leguía 1999). En general, las helmintiasis en alpacas adultas presentan cargas parasitarias menores, con tendencia a mostrar tasas de fecundación más reducidas (Yucra 2002).
La prevalencia registrada para coccidias (76.4%) fue superior a las observadas por otros autores en alpacas y llamas de Oruro, Bolivia (Campero 1990), en alpacas de Perú (Cabrera 2002) y en alpacas de Chile (Rojas et al. 1993), pero inferior a la registrada por Alandia (2003) en llamas de Cochabamba y por Beltrán-Saavedra et al. (2011a) en vicuñas de vida libre estudiadas en una región aledaña a la zona de muestreo del presente trabajo en Bolivia. Las diferencias observadas con los CSAs domésticos estudiados en otros sitios, posiblemente se deban a las condiciones de hábitat y sanitarias que varían de región a región. El número elevado de alpacas con coccidias posiblemente se deba al pastoreo libre de praderas nativas y de bofedales en forma extensiva donde, hasta el momento del muestreo en este estudio, no existía ningún plan sanitario de desparasitación contra estos protozoos. Aunque no se tiene claro el rol de estos protozoos en la salud de las alpacas, anteriormente fueron reportados algunos casos de mortandad en crías y juveniles de camélidos domésticos (Leguía 1999), constituyéndose las primeras crías de las pariciones en amplificadores de estos patógenos, y las crías de aproximadamente dos a tres meses de edad tendrían mayores riesgos epidemiológicos por coccidiosis (Rodríguez et al. 2012).
La presencia de alpacas con elevada carga parasitaria por cestodos (16.4%), en este estudio, podría ser consecuencia de la alta interacción que existe entre las alpacas y los rumiantes ovinos, tal como lo observaron Beldomenico et al. (2003) en guanacos en Argentina. Los ovinos también estuvieron presentes en los sitios de muestreos de alpacas y permitió ver que el parásito es capaz de adaptarse a las condiciones ecológicas de la puna norteña y puna húmeda en el área de estudio. Anteriormente, Beltrán-Saavedra et al. (2011a), también evidenciaron en la ecorregión de puna norteña en Apolobamba, la presencia de cestodos de ovinos en vicuñas, con menor prevalencia (3.1%) y carga parasitaria, sugiriendo una posible transmisión interespecie.
Previamente fueron reportadas prevalencias del trematodo Fasciola hepatica en ganado de las provincias Ingavi (bovinos= 4.32%), Los Andes (bovinos= 10.89% y ovinos= 68.5%), Omasuyos (bovinos= 5.08%), Manco Kapac (bovinos= 3.77%) y Murillo (bovinos= 40.57% y ovinos= 68.5%) del departamento de La Paz (Góngora 2006).
Este trematodo también fue reportado en bovinos de los departamentos de Chuquisaca (López 1989, Osinaga 1991, Terrazas 1993), Potosí (Cuevas 1980), Santa Cruz (Chavez 1996) y Tarija (Coca 1990). El único hallazgo de Fasciola spp. (1.8%) en este estudio fue dado en la comunidad de Caalaya en la ecorregión de puna húmeda, estableciendo una nueva área endémica en La Paz - Bolivia. Como ya se mencionó, las alpacas estudiadas conviven con ovinos y estos últimos podrían representar un factor de riesgo importante en zonas bajas como lo indica Leguía (1999), sin embargo, no se observó el trematodo en las comunidades de Cañuhuma y Medallani, donde las alpacas habitan en ambientes serranos más drenados, comparados con los de Caalaya, no dando condiciones ambientales para el desarrollo de hos-pederos intermediarios, tal como lo indican los estudios de Campero (1990), Leguía (1999) y Yucra (2002). La presencia del trematodo Fasciola spp., en la comunidad de Caalaya a diferencia de las otras dos comunidades de la ecorregión de puna norteña, indicaría que la ecorregión de puna húmeda, estaría dando las condiciones adecuadas para la presencia de hospedadores intermediarios caracoles, posiblemente Lymnaea truncatula hallados anteriormente en el norte del altiplano boliviano por Jabbour-Zahad et al. (1997), permitiendo el desarrollo del ciclo biológico en el ganado y con riesgos a la salud pública en esta área endémica al tratarse de una zoonosis (Acha & Szyfres 2003), y reportada en humanos de las provincias Omasuyos, Manco Kapac y Los Andes del departamento de La Paz, con prevalencias de 2 a 93.2% (Góngora 2006). No obstante, esta teoría deberá ser estudiada a profundidad más adelante para determinar la presencia de los caracoles y el parásito en otras comunidades de esta ecorregión en el ANMI Apolobamba.
Ectoparásitos. El 58.5% de las alpacas estudiadas en época de lluvias presentaron piojos. En general las infestaciones por piojos son consideradas como una importante causa de pérdidas económicas en CSAs domésticos, las cuales son más comunes en comunidades campesinas y pequeños rebaños (Leguía 1999). Afecta principalmente a animales jóvenes, sin embargo, los piojos también pueden afectar a animales de diferentes edades bajo con-dijones de estrés y debilitamiento. Las piojeras en CSAs son más prevalentes durante el invierno y primavera (Leguía 1999).
La presencia de B. breviceps (14.6%) constituye el primer reporte de este parásito en Bolivia. Anteriormente se reportaron en alpacas de Argentina (Rudow 1866) y de Chile (González-Acuña et al. 2007). En infestaciones masivas por B. breviceps, puede observarse alopecia con caída del vellón en forma irregular al ser masticadores de fibra (Leguía 1999), provocan alteraciones en el comportamiento de sus hospederos causando deterioro en la performance productiva (Cicchino et al. 1998). La especie B. breviceps estuvo presente en las comunidades de Caalaya, Cañuhuma y Curva en las ecorregiones de puna norteña y de puna húmeda, demostrando su amplia distribución dentro el área de estudio.
Ejemplares de M. mazzai (37.8%) fueron encontrados en alpacas de las cuatro comunidades estudiadas. Considerando que este género es suctopicador, pueden ser causantes de anemias (Leguía 1999). Por otro lado, M. mazzai ha sido descrito como el piojo de mayor importancia en explotaciones intensivas de CSAs, al producir una baja importante en ganancia de peso, debido al estrés y alteraciones de la fibra por excesivo rascado (Cicchino et al. 1998). Este hallazgo se constituye en el primer reporte en alpacas para Bolivia. Previamente, este piojo fue reportado en llamas de Bolivia y Argentina (Neumann 1909, Arce de Hamity & Ortíz 2004); en vicuñas de Bolivia y Argentina (Beltrán-Saavedra et al. 2011a, Arzamendia et al. 2012), y en alpacas de Perú y Chile (Cicchino et al. 1998 y González-Acuña et al. 2007).
Fueron identificados Microthoracius praelongiceps (40.2%) y Microthoracius minor (17.1%) en tres comunidades de las ecorregiones de puna norteña y puna húmeda, a excepción de Curva, también de puna húmeda. En este estudio se encontraron diferencias significativas entre sexos, predominando infestaciones de M. praelongiceps en alpacas hembras, sin embargo dado que los piojos a diferencia de otros ectoparásitos, desarrollan su ciclo biológico completo en sus hospedadores (Wall & Shearer 2001) y su transmisión depende de un contacto directo (Rózsa 1997), en este caso probablemente se trate de un efecto ocasionado por el manejo reproductivo, dado que comúnmente los machos son separados del hato, quedando aislados de las hembras, juveniles y crías, disminuyendo sus probabilidades de infestarse y re-infestarse.
El hallazgo de M. praelongiceps y M. minor se constituyen en el primer reporte en alpacas de Bolivia. M. praelongiceps fue reportado en llamas de Bolivia (Werneck 1932), en alpacas y llamas de Chile (González-Acuña et al. 2007, Neumann 1909), y en llamas y vicuñas de Argentina (Arce de Hamity & Ortíz 2004, Arzamendia et al. 2012); y M. minor fue reportado en vicuñas de Bolivia, y en llamas de Argentina (Beltrán-Saavedra et al. 2011a, Arce de Hamity & Ortíz 2004, Werneck 1935).
Las garrapatas Amblyomma parvitarsum encontradas (4.9%), constituyen el primer reporte del ácaro en alpacas de Bolivia. Estos Ixodoideos atacan preferentemente a los CSAs, aunque en Argentina existen algunos registros en otros animales domésticos (Guglielmone & Nava 2006). Es una garrapata endémica de Argentina, Bolivia, Chile y Perú con distribución Andina y Patagónica (Guglielmone et al. 2003, Guglielmone & Viñabal 1994). Las alpacas positivas a esta garrapata eran procedentes de las comunidades de Cañuhuma y Medallani pertenecientes a la ecorregión de puna norteña. Este hecho puede deberse a que el hospedero de las fases juveniles de A. parvitarsum son reptiles del genero Liolaemus (González-Acuña et al. 2004 y Muñoz-Leal et al. 2013), los cuales, en este estudio, fueron observados comúnmente en las localidades de la ecorregión de puna norteña, pero no en las de puna húmeda. Estas garrapatas se localizan en la región perianal de los animales, alimentándose de sangre, para lo cual perforan la piel causando heridas y una intensa irritación debida a la saliva del parásito. El animal puede presentar cuadros anémicos, intranquilidad, disminución del apetito, complicaciones bacterianas secundarias y miasis en las zonas lesio-nadas (Leguía 1999).
La baja presencia de individuos con lesiones de sarna por Sarcoptes scabiei var. aucheniae (4.9%) posiblemente se deba a condiciones ambientales locales adversas, sin embargo tiene que considerarse que un mal manejo productivo y sanitario podría ser una importante causa de pérdidas económicas debido a un incremento de los contagios en los rebaños estudiados. Durante este estudio se evidenció lesiones de sarna severa y generalizada en dos alpacas de un rebaño de la comunidad de Curva, en el cuál no se aplicaban desparasitaciones. Esta comunidad presentó la mayor prevalencia (30%) por sarnas, y se debería a un menor control ectoparasitario. La sarna es estacional, observándose un mayor contagio, extensión y gravedad de las lesiones durante la primavera y verano, épocas en que existen condiciones favorables para el desarrollo del parásito, debido a la mayor temperatura, humedad y mayor largo de fibra de los CSAs (Leguía 1999). Este ácaro también presentó baja prevalencia (5.6%) en vicuñas de Apolobamba - La Paz (Beltrán-Saavedra et al 2011a).
La mayor prevalencia en alpacas fue registrada para endoparásitos nematodos, siguiendo en importancia las coccidias, los piojos suctopicadores y masticadores, y en menor medida los ácaros de sarna y las garrapatas, comúnmente compartidos entre especies de camélidos sudamericanos (Leguía 1999). En un anterior estudio en vicuñas, Beltrán-Saavedra et al. (2011a) describieron un perfil sanitario similar al reportado en este trabajo. En este escenario, las alpacas estudiadas, con un pobre manejo sanitario, que coexisten en las mismas áreas de pastoreo con vicuñas y ovinos podrían estar intercambiando parásitos e incrementando su transmisión. En consecuencia, la presencia de las tres especies de animales, indicaría una elevada disponibilidad de formas parasitarias transmisibles y de hospedadores para completar ciclos biológicos. La probable interacción de cestodos del género Monezia desde ovinos hacia alpacas, debe investigarse para establecer su relación filogenética. Además, la presencia de trematodos del género Fasciola en la ecorregión de puna húmeda tienen importancia zoonotica y debe investigarse su situación endémica en otras comunidades ganaderas de las ecorregiones de puna húmeda y yungas del ANMI Apolobamba.
Basados en estos hallazgos, concluimos que urge realizar planes de manejo integral de ecosistemas en las localidades estudiadas, incluyendo el establecimiento de planes sanitarios enfocados al control de helmintos, ectoparásitos y protozoos, y planes de manejo de pradera, tomando en cuenta la carga animal doméstica y silvestre, rotación de pasturas, la dispersión de estercoleros (Leguía 1999), la separación de crías de CSAs domésticos por edades (Rodríguez et al. 2012), para minimizar efectos negativos a la productividad de las alpacas. También se concluye que las características ecorregionales y la disponibilidad de diferentes especies hospedadoras domésticas y silvestres, son factores predisponentes que deben tomarse en cuenta dentro los planes de manejo mencionados.
Agradecimientos
Al Área Natural de Manejo Integrado Nacional Apolobamba y al Cuerpo de Guardaparques por el permiso y la cooperaron brindada. A las comunidades de Caalaya, Cañuhuma, Curva y Medallani que permitieron el estudio en sus alpacas. Al Dr. Manuel Tantaleán por su colaboración en la identificación de Lamanema spp. A Robert Wallace y Erika Alandia de WCS - Bolivia por la revisión crítica de este manuscrito. Este trabajo fue realizado dentro del Programa Gran Paisaje Madidi-Tambo-pata de WCS - Bolivia, y del Programa Veterinaria para la Conservación de WCS - Bolivia, y financiado por la Gordon and Betty Moore Foundation.
Referencias
Acha N, Szyfres B. Zoonosis y enfermedades transmisibles comunes al hombre y los animales: Vol. III. 3a ed. Washington DC: Publicaciones Científicas y Técnicas Nº 580. OPS-OMS, Washington D.C.; 2003.
Alandia E. Animal Health Management in a Llama Breeding Project in Ayopaya, Bolivia. Parasitological Survey. Master Thesis. University of Hohenheim. Hohenheim; 2003.
ARAUCARIA - SERNAP. Manejo Sostenible de la Vicuña en Apolobamba. La Paz - Bolivia: Agencia Española de Cooperación Internacional, La Paz; 2004.
Arce de Hamity M, Ortiz F. Ectoparásitos (Insecta y Arachnida) sobre animales domésticos de la quebrada de Humahuaca y Puna (Jujuy, Argentina). IDESIA (Chile). 2004; 22(1): 55-56.
Arzamendia Y, Neder LE, Marcoppido G, Ortiz F, Arce M, Lamas HE, et al. Effect of the prevalence in the behavioral patterns of wild vicuñas (Vicugna vicugna). J. Camelid Sci. 2012; 5: 105-177.
Bagley CV. Economics of deworming beef cattle & herd monitoring with fecal egg counts. Logan: Utah State Univ. The Compendium Food Animal Supplement, Utah; 1997.
Beldomenico PM, Uhart M, Bono MF, Marull C, Baldi R, Peralta JL. Internal Parasites of Free-ranging guanacos from Patagonia. Vet Parasitol. 2003; 118: 71-77.
Beltrán-Saavedra LF, Nallar-Gutiérrez R, Ayala G, Limachi JM, Gonzales-Rojas JL. Estudio sanitario de vicuñas en silvestría del Área Natural de Manejo Integrado Nacional Apolobamba, Bolivia. Ecol Bolivia. 2011a; 46(1): 14-27.
Beltrán-Saavedra LF, Limachi M, Guglielmone A. Reporte de Vicugna vicugna Molina, 1982 como hospedador de Amblyomma parvitarsum Neumann 1901 (Acari: Ixodidae) en Bolivia. J Selva Andina Res Soc. 2011b; 1(2): 40-44.
Boero JJ. Las garrapatas de la República Argentina (Acarina: Ixodoidea). Depto Edit Univ. Buenos Aires, Buenos Aires; 1957.
Brolin-Schlanger L. Prevalence of external parasites in alpacas and llamas in Andean Ecuador: Swedish University of Agricultural Science. Minor field studies-International Office. Uppsala; 2003.
Cabrera GM. Mapeo Parasitológico en Alpacas en la Zona de Cajamarca. Asociación Peruana de Producción Animal. Ayacucho; 2002.
Cafrune MM, Aguirre DH, Rickard LG. First report of Lamanema chavezi (Nematoda: Trichostrongyloidea) in llamas (Lama glama) from Argentina. Vet. Parasitol. 2001; 97: 165-168.
Campero F. Situación Actual de los Camélidos Sudamericanos en Bolivia. FAO. Roma; 2005 55pp.
Campero H. Evaluación coprológica e identificación de endoparásitos en llamas (Lama glama) y alpacas (Lama pacos) y su control con plantas medicinales nativas. Tesis Licenciatura. Universidad Mayor de San Simón. Cochabamba; 1990.
Chavez A. Prevalencia de la Fasciola hepatica bovina en la Provincia ichilo del departamento de Santa Cruz. Tesis Licenciatura. Universidad Autónoma Gabriel René Moreno; 1996.
Cicchino AC, Muñoz ME, Bulman GM, Diaz JC, Laos A. Identification of Microthoracius mazzai (Phthiraptera: Anoplura) as an Economically Important Parasite of Alpacas. J. Med. Entomol. 1998; 35 (6): 922-930.
Coca AE. Frecuencia de bovinos infectados con Fasciola hepatica en el área central de la provincia Cercado, Tarija mediante el examen final a través del método de sedimentación N.I.A.H. Tesis Licenciatura. Universidad Autónoma Gabriel René Moreno; 1990.
Cuevas CF. Prevalencia de las fasciolas con bovinos sacrificados en el Matadero Municipal de Potosí entre los años 1965 a 1977. Tesis de Grado. Universidad Autónoma Gabriel René Moreno; 1980.
Dios R. Sistemática y biología de los Ixodídeos argentinos, contribución a su estudio. Ann Soc Rural Argentina. 1917; 341: 249-251.
Estrada-Peña A, Venzal JM, Mangold AJ, Cafrune MM, Guglielmone AA. The Amblyomma maculatum Koch, 1844 (Acari: Ixodidae: Amblyomminae) tick group: diagnostic characters, description of the larva of A. parvitarsum Neumann, 1901, 16S rDNA sequences, distribution and host. Syst Parasitol. 2005; 60: 99-112.
Fowler ME. Medicine and Surgery of South American Camelids (llama, alpaca, vicuña, guanaco). 2a ed. Blackwell Publishing Professional. Iowa University Press. Iowa; 1998.
Góngora RC. Prevalencia de Fasciola hepatica en bovinos faeneados en el matadero municipal de la ciudad de La Paz. Octubre de 2005 a marzo de 2006. Tesis Licenciatura. Universidad Autónoma Gabriel René Moreno; 2006.
González-Acuña D, Venzal JM, Fabry M, Guglielmone AA. Liolaemus jamesi (Boulanger, 1891) (Reptilia: Tropiduridae), a host for the larva of Amblyomma parvitarsum Neumann, 1901 (Acari: Ixodidae). Syst Appl Acarol. 2004; 9: 33-36.
González-Acuña D, Cabezas I, Moreno L, Castro D. Nuevos registros de Phthiraptera (Artropoda: Insecta) en Lama pacos Linnaeus, 1758 en Chile. Arch Med Vet. 2007; 39(1): 71-72.
Guglielmone AA, Estrada-Peña A, Keirans AJ, Robbins RG. Ticks (Acari. Ixodida) of the Neotropical Zoogeographical Region. Special Publication of the International Consortium on Ticks and Tick-borne Diseases. Países Bajos; 2003.
Guglielmone AA, Nava S. Las garrapatas argentinas del género Amblyomma (Acari: Ixodidae): Distribución y hospedadores. RIA. 2006; 35 (3): 133-153.
Guglielmone AA, Viñabal A. Claves morfológicas dicotómicas e información ecológica para la identificación de las garrapatas del género Amblyomma Koch, 1844 de la Argentina. Rev Investig Agropecu. 1994; 25: 39-64.
Ibisch PL, Mérida G. Biodiversidad: La riqueza de Bolivia. Ed. FAN-Bolivia. Santa Cruz de la Sierra; 2003. 638 pp.
Jabbour-Zahab R, Pointier JP, Jourdane J, Jarne P, Oviedo JA, Bargues MD, et al. Phylogeography and genetic divergence of some lymnaeid snails, intermediate hosts of human and animal fascioliasis with special reference to lymnaeids from the Bolivian Altiplano. Acta Trop. 1997; 64(3-4): 191-203.
Karesh WB, Uhart MM, Dierenfeld ES, Braselton WE, Torres A, House C, et al. Health evaluation of free-ranging guanaco (Lama guanicoe). J. Zoo. Wildlife. Med. 1998; 29(2): 134-141.
Kraft H, Schillinger D. Métodos de laboratorio clínico en medicina veterinaria de mamíferos domésticos. Edición en español. Acribia. Zaragoza; 1998.
Leguía G. The epidemiology and economic impact of llama parasites. Parasitol Today. 1991; 7: 54-56.
Leguía G. Enfermedades parasitarias de camélidos sudamericanos. Mar Eirl. Lima; 1999.
Lopez SD. Frecuencia de distomatosis hepatica bovina en el cantón Sauces, provincia Hernando Siles del departamento de Chuquisaca. Tesis Licenciatura. Universidad Autónoma Gabriel René Moreno; 1989.
Macdonald DW. Ed. The new encyclopaedia of mammals. Oxford Press. 2001.
Mastropaolo M, Beltrán-Saavedra LF, Guglielmone AA. The ticks (Acari: Ixodida: Argasidae, Ixodidae) of Bolivia. Ticks Tick-Borne Dis. 2014; 5(2): 186-194.
Morrone JJ. Biogeographic areas and transition zones of Latin América and the Caribbean Islands based on panbiogeographic and cladistic analysis of the entomofauna. Annu Rev Entomol. 2006; 51: 467-494.
Muñoz-Leal S, González-Acuña D, Beltrán-Saavedra LF, Limachi JM, Guglielmone AA. Amblyomma parvitarsum (Acari: Ixodidae): Localities, hosts and host-parasite ecology. Exp. Appl. Acarol. 2013; 62(1): 91-104.
Neumann LG. Note sur les Pediculides. Arch Parasitol. 1909; 13: 497-537.
Neumann LG. Révision de la famille de ixodidés (4e mémoire). Mém Soc Zool Fr. 1901; 14:249-372.
Osinaga PC. Frecuencia de la Fasciola hepatica en el matadero municipal de Sucre. Tesis Licenciatura. Universidad Autónoma Gabriel René Moreno; 1991.
Palma R. Slide- Mounting of lice: a detailed description of the Canada balsam technique. New Zeal Entomol. 1978; 6: 432-436.
Pereira JA. Determinación de parásitos gastrointestinales en llamas (Lama glama) de la Estación Experimental de Patacamaya. Tesis Licenciatura. Universidad Autónoma Gabriel René Moreno. Santa Cruz de la Sierra; 1990. 44 pp.
Rodríguez A, Casas E, Luna L, Gavidia C, Zanabria V, Rosadio R. Eimeriosis en crías de alpacas: prevalencia y factores de riesgo. Rev. Inv. Vet. Perú. 2012; 23(3): 289-298.
Rojas M, Núñez A, Alva J. Observaciones del desarrollo y sobrevivencia de Lamanema chavezi en condiciones naturales. Rev Cam Sud. 1986; 2: 34-38.
Rojas M, Lobato I, Montalvo M. Fauna parasitaria de camélidos y ovinos en pequeños rebaños mixtos familiares. Inv. Pecuarias. 1993; 6(1).
Rózsa L. Patterns in the abundance of avian lice (Phthiraptera: Amblycera, Ischnocera). J Avian Biol. 1997; 28: 249-254.
Rudow F. Sechs neue Haarlinge, (Ebenda Bd S 27 109-112). Taf 5-7.
SERNAP. Información técnica del Sistema Nacional de Áreas Protegidas de Bolivia. Ministerio de Desarrollo Sostenible y Planificación, Servicio Nacional de Áreas Protegidas - GTZ. La Paz; 2000.
Soulsby EJ. Parasitología y Enfermedades Parasitarias de los Animales Domésticos. 7a ed. Interamericana. México D.F.; 1987.
Sutton CA, Durette-Desset M. Contribución al conocimiento de la fauna parasitológica argentina XIV. Presencia de Lamanema chavezi Becklund, 1963 (Nematoda, Molineidae, Nematodirinae) parásito de camélidos en Lagidium viscaciaboxi. B. Mus. Natl. Hist. Nat. 1985; 4: 791-794.
Terrazas SMJ. Frecuencia de Fasciola hepatica bovina en la provincia Hernando Siles del departamento de Chuquisaca. Tesis Licenciatura. Universidad Autónoma Gabriel René Moreno; 1993.
Thrusfield M. Epidemiología Veterinaria. 1a ed. en español. Acribia. Zaragoza; 1990. 339 pp.
Ueno H, Gutierrez VC. Manual Para Diagnóstico Das Helmintoses De Rumiantes. Facultade de Medicina Veterinaria, Universidade Federal do Rio Grande do Sul. JICA. Porto Alegre; 1983.
Wall R, Shearer D. Veterinary ectoparasites: biology, pathology and control. 2a ed. Blackwell Science; 2001.
Werneck FL. Sobre una nova especie de Anoplura parasita da lhama (nota previa). Rev Medico-Cirurg Brasil. 1932; 40: 346-348.
Werneck FL. Microthoracius minor e demais especies do mesmo genero. Rev Ent Rio de J. 1935; 5, 107-116.
Yucra D. Carga parasitaria gastrointestinal, lesiones anatomo-histopatológicas, respuesta celular y patrones de respuesta humoral en alpacas de una comunidad campesina - Puno. Tesis Maestria. Universidad Nacional Mayor de San Marcos. Lima; 2002.
Notas de autor
fabian-beltran@hotmail.com
Declaración de intereses
Enlace alternativo