INTRODUCCIÓN
A través
del tiempo se han buscado alternativas para
sustituir
materias primas cuyo uso no se considera
adecuado;
bien sea por factores como costos, generación
de
residuos, efectos en la salud, entre otros.
Un claro
ejemplo es el empleo de pigmentos alimenticios
sintéticos
que ocasionan problemas de salud tales
como
alergias, complicaciones digestivas e incluso
cáncer
(Velázquez, 2012). Por esta razón, reemplazar
dichos
pigmentos por pigmentos naturales se ha convertido
en una
necesidad. Una de las posibles alternativas
para dicha
sustitución son los carotenoides provenientes
de
microalgas, los cuales corresponden a
lípidos
simples, específicamente terpenos (Plaza, Herrero,
Cifuentes,
& Ibáñez, 2009). Sin embargo, para
conseguir
una producción viable de estos compuestos
es
importante seleccionar el factor de estrés con mayores
beneficios
para el proceso a nivel de productividad
y costos,
así como realizar una adecuada selección
de la cepa.
Por
consiguiente, el objetivo de este trabajo fue evaluar
el
potencial de producción de carotenoides de
la
microalga Scenedesmus dimorphus en un
recipiente
adaptado
bajo una condición experimental seleccionada,
así como
establecer la proporción de carotenoides-
lípidos
producidos bajo un factor de estrés
determinado.
MATERIALES Y MÉTODOS
Selección de factor de estrés
En primera
instancia, se llevó a cabo una revisión bibliográfica
de
publicaciones de los últimos diez años
sobre los
factores que tienen mayor efecto en la inducción
de
carotenoides en la microalga Scenedesmus
dimorphus. Para ello, se creó una matriz de selección
(tabla 1)
que incluía estrategias a nivel nutricional;
es decir,
aquellas en las que se aplican cambios
en la
composición del medio de cultivo, como
la
limitación de nitrógeno, fosfato y azufre, o a nivel
físico, por
la manipulación de las condiciones operacionales
y factores
externos como luz, salinidad y pH.
En esta
matriz de selección se evaluaron parámetros
como la
viabilidad de aplicación según sistemas de
instrumentación
y control, tiempo de duración del
experimento,
costos en la aplicación del factor, especie
de microalga, productividad de
carotenoides y factor escala. Posteriormente, a partir del puntaje
obtenido,
se seleccionó como factor de estrés la salinidad,
teniendo
como referente las condiciones presentes en el Laboratorio de la Fundación
Universidad
de América (Bogotá).
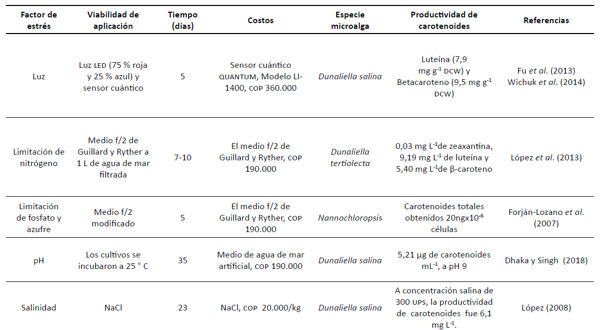 Tabla 1
Matriz de selección del factor de estrés
Tabla 1
Matriz de selección del factor de estrés
Condiciones del pre-experimento
Se evaluaron dos tipos de sal (NaCl y KNO3) a concentraciones de 0,5M; 0,6M; 0,7M y 0,8M.
Montaje del pre-experimento
Para esta
fase del experimento, se pusieron en marcha
nueve
cultivos con volumen de trabajo de 300 mL,
de los
cuales cuatro correspondían a cultivos para adicionar
cloruro de
sodio y otros cuatro para adicionar
nitrato de
potasio. Esta adición se realizó al presenciar
el inicio
de la fase estacionaria de los cultivos en
la curva de
crecimiento realizada, a través de los conteos
diarios por
cámara de Neubauer. Al último cultivo,
denominado
blanco, no se le indujo ningún factor
de estrés.
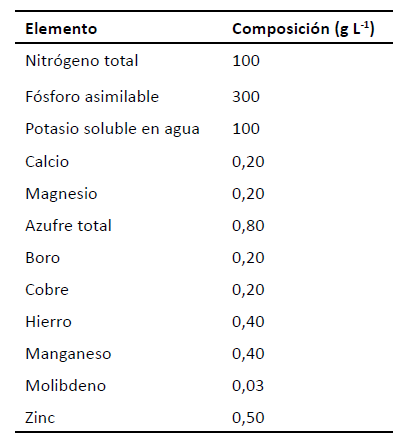
De los 300 mL, 250 mL correspondían
a medio de
cultivo Foliagro (tabla 2) y 50 a microalga
Scenedesmus
dimorphus con un inóculo inicial de
4,03x105 cel mL-1. El medio
de cultivo se preparó siguiendo
la
proporción de 2 mL de Foliagro por litro de
agua
destilada.
Tabla 2
Composición del medio de cultivo
 Fuente: fabricantes
Fuente: fabricantes
A
continuación, los recipientes fueron dispuestos en
una
incubadora bajo condiciones axénicas para favorecer
el
crecimiento de los cultivos. La aireación se
realizó por
medio de bombas de acuario de marca
Jeneca de
cuatro salidas cada una, manteniendo un
caudal de
aire de 4 L min-1, las cuales se encontraban
conectadas
a mangueras de 3/16” que llegaban hasta
los
recipientes adaptados, permitiendo así una agitación
continua –complementada,
en ocasiones, con
agitación
manual– para evitar la sedimentación del
cultivo.
Siguiendo la recomendación de Rubio, Sandoval,
Ruíz, &
Tovar (2017), se empleó luz roja a 680
nm a lo
largo de la incubadora por medio de cintas
LED, con
una intensidad promedio de 12,1 W m-2. Sin
embargo, al
llegar a fase estacionaria se aplicó solo
luz azul
para la generación de carotenoides. Por otro
lado, se
fijó un fotoperiodo de 12 horas de luz y 12 de
oscuridad,
controlado por un temporizador, para que
el cultivo
no se viera afectado por fotoinhibición. La
temperatura
se mantuvo en condiciones del ambiente
del
laboratorio, aproximadamente 20 °C.
Crecimiento celular
Por medio
del conteo por cámara de Neubauer en cinco
cuadrantes
se calculó la concentración celular aplicando
la
siguiente ecuación (Murcia & Parra, 2018):
Por su
parte, la velocidad de crecimiento (μ) y el tiempo
de
duplicación (tg) fueron calculados utilizando las
ecuaciones
2 y 3, respectivamente , donde X1 y X2 son
las
concentraciones a los tiempos 1 y 2 (t1, 2) (Vega &
Voltolina,
2007)
Cultivo con salinidad
El conteo
celular en cámara de Neubauer se llevó a
cabo
diariamente para evidenciar, a través de la curva
de
crecimiento, el día en que se llegó a fase estacionaria
(día 7).
Las sales fueron agregadas a los ocho recipientes
adaptados
en el día diez, obteniendo concentraciones
de 0,5;
0,6; 0,7 y 0,8 N.
Cuantificación de carotenoides y clorofilas por espectrofotometría UV-VIS
Para la
extracción de pigmentos liposolubles se siguió
el
protocolo de los investigadores Strickland y Parsons
(1972) y
Jeffrey y Humphrey (1975), el que describe
que para la
extracción de los pigmentos se debe separar
el medio de
cultivo de la biomasa, lo cual se realizó
mediante
centrifugación a 3.200 rpm en centrífuga
Baby I 206
por un periodo de 15 minutos. Al concluir
la
centrifugación se desechó el sobrenadante mediante
pipeta
Pasteur. La pastilla celular resultante fue dispuesta
en un tubo
de vidrio limpio con tapón de rosca,
el cual fue
cubierto para evitar la foto-oxidación.
A este se
añadieron 3 mL de acetona al 90 %, agitando
para lograr
la resuspensión de la pastilla celular y
la
extracción de los pigmentos. Los tubos con el extracto
se dejaron
reposar durante 24 horas continuas
en baño de
hielo. Luego, se realizó centrifugación a
3.200 rpm
por 15 minutos, seguida de separación del
extracto de
pigmentos con la debida protección de
la luz.
Finalmente, se leyó su absorbancia en un espectrofotómetro
previamente
calibrado a longitud de
onda de 480
y 510 nm para los carotenoides totales y
a 664 y 647
nm para clorofilas. Con el fin de calcular
la
concentración de las clorofilas y los carotenoides
totales,
expresada en xpr-1 de extracto, se usaron las
ecuaciones
propuestas en el protocolo descrito por
Vega y
Voltolina (2007), donde A es la absorbancia
de
la muestra:
Por último,
con el objetivo de obtener la concentración
en μg de
carotenoides mL-1 de cultivo, los resultados
obtenidos
en las ecuaciones fueron multiplicados
por el
volumen del extracto y divididos por el volumen
de muestra.
Diseño factorial
Mediante el
software Excel, se planteó un análisis por
diseño
factorial 24, siendo los factores los dos tipos
de sal
(NaCl y KNO3) y los niveles las concentraciones
de 0,5M;
0,6M; 0,7M y 0,8 M. Además, se formuló la
hipótesis
nula, H0: la concentración de sal no genera un cambio significativo en la
concentración de carotenoides
totales, y
la hipótesis alternativa, H1: la concentración
de sal
genera un cambio significativo en la
concentración de carotenoides totales.
Condiciones del experimento
El
experimento se llevó a cabo en dos recipientes
adaptados
de 4 L, con un volumen de trabajo total de
3.535 mL,
de los cuales 3 L eran del medio de cultivo
y 535 mL de
microalga, con un inoculo inicial de
2x106 cel
mL-1. Un
recipiente correspondía al blanco y
el otro al
cultivo con el factor de estrés. Por medio de
los conteos
por cámara de Neubauer se determinó el
día de
inicio de la fase estacionaria (día 12). En el día
14 se
agregaron 138,92 gramos de KNO3 a un volumen
de 2.290 mL
para obtener la concentración de 0,6 N.
Se
esperaron 6 días de conteo después de aplicada la
sal para
observar si se presentaba o no viraje de color
(siendo
indicativo de presencia de carotenoides),
lo cual fue
ratificado mediante espectrofotometría.
Además, se
aplicaron las mismas condiciones operacionales
del
pre-experimento (longitud de onda, temperatura,
velocidad de agitación).
Secado de la biomasa y productividad
La biomasa
fue concentrada en 12 tubos de 14 mL
cada uno,
retirando la mayor cantidad de medio de
cultivo
posible a través del uso de una centrifuga Baby
I 206 a
3.200 rpm por 5 minutos. El sobrenadante fue
separado,
recolectando 648 mL de pastilla microalgal
en 4 moldes
desechables de aluminio. Los moldes
con 162 mL
de biomasa cada uno fueron dispuestos
en una
estufa Nabertherm (TR 120) por 18 horas a 60
°C, con el
fin de retirar la mayor cantidad de humedad
posible y
conservar la calidad de la muestra. Finalmente,
se calculó
el peso seco y la productividad con
base en las ecuaciones 9 y 10 (Vega
& Voltolina, 2007):
Cromatografía HPLC
La muestra
seca fue entregada al Laboratorio de Toxicología
de la
Universidad Nacional de Colombia, donde
se realizó
la extracción de lípidos y la determinación del perfil de ácidos grasos
mediante el Método
Folch, con
el objetivo de plantear la correspondiente
proporción
carotenoides-lípidos (Restrepo, Díaz, &
Pardo, 2012).
RESULTADOS Y DISCUSIÓN
Resultados del pre-experimento
En la
figura 1 se representan las fases de crecimiento
celular
observadas gracias al conteo diario. En los
primeros
tres días se dio la fase de adaptación; del
día 3 al 7
el crecimiento exponencial; y del día 7 al 10
se alcanzó
la fase estacionaria. Debido a que se buscaba
favorecer
una mayor acumulación de carotenoides,
la aplicación
del estrés salino se realizó en el día
10,
mientras el cultivo estaba aún en fase estacionaria
(Fernández-Cordero,
2013), observando luego una
variación
en la concentración celular de los cultivos
dependiente
de la concentración salina y la sal aplicada
en cada recipiente adaptado.
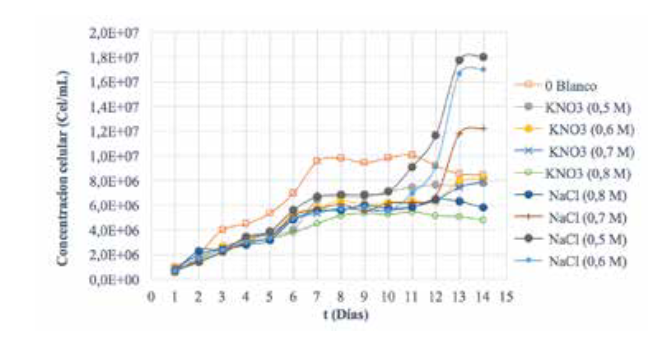 Figura 1
Curva de crecimiento celular pre-experimento
Figura 1
Curva de crecimiento celular pre-experimento
En cuanto a
los cultivos adicionados con NaCl 0,5M,
0,6M y
0,7M, se observó un aumento significativo
de la
concentración celular, alcanzando un máximo
de 1,8x107 ± 25,46 cel
mL-1. No se
presentó muerte
celular. Se
observó, además, un cambio de morfología
(figura 2),
siendo inicialmente delgada y alargada,
pero
circular después de la aplicación de la sal. Esto
se debe a
que las altas concentraciones de nutrientes,
producen un
aumento en la relación superficie/volumen
(Acevedo
& Ramírez, 2003). Sin embargo, en el
cultivo con
NaCl 0,8 M no aumentó la concentración
celular del
cultivo; en cambio, ocurrió fase de muerte
del día 13
al 14, lo que indicaría, como señalan Moronta,
Mora y
Morales (2006), que esta concentración
es inhibitoria del crecimiento celular.
 Figura 2
Cambio de la morfología
Fuente: elaboración propia
Figura 2
Cambio de la morfología
Fuente: elaboración propia
Por otro
lado, al adicionar KNO3 a las mismas concentraciones
de 0,5 M,
0,6 M y 0,7 M, la concentración
celular no
presentó crecimiento significativo, alcanzando
un máximo
de 8,15x106 ± 8,49 cel mL-1. Los cultivos
siguieron
en fase estacionaria durante los días
posteriores
a la adición de la sal, lo que podría deberse
a que la
microalga estaba sometida a un estrés
salino
mayor que con el NaCl. Finalmente, la concentración
0,8M de
KNO3 también indujo fase de muerte
del día 12
al 14. Con base en estos resultados, se estableció
un periodo
de dos días después de alcanzar
la fase
estacionaria para agregar la salinidad; lo anterior con el fin de prevenir la
muerte celular, dado que
se empleó
una concentración alta, como se verá más
adelante.
En la tabla
3 se muestran los resultados de velocidad
específica
de crecimiento y tiempo de duplicación
para cada
uno de los cultivos en el pre-experimento.
Se observa
que la mayor velocidad específica de
crecimiento
fue alcanzada por las concentraciones de
0,5 M de
KNO3 y NaCl, mientras que el mayor tiempo
de
duplicación corresponde a la concentración 0,8 M
para KNO3 y 0,6 M para NaCl.
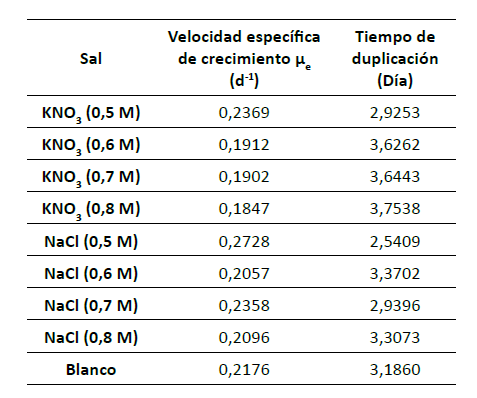 Tabla 3
Velocidad específica de crecimiento y tiempo de duplicación preexperimento
Tabla 3
Velocidad específica de crecimiento y tiempo de duplicación preexperimento
Al realizar
el análisis espectrofotométrico a estas
muestras,
se observó que el cultivo con KN3 0,6 M, obtuvo
la mayor
acumulación de carotenoides: 0,3357
± 0,02 μg
mL-1 como
muestra la figura 3. Al respecto,
Přibyl
(2016) obtuvo 34 μg de carotenoides mL-1
con KNO3,
1M. La gran diferencia en estos resultados
puede
deberse a varios factores: el autor aplicó un estrés
combinado
nutricional-lumínico, tuvo mejor control
de las
condiciones del cultivo, o pudo haber modificado
la especie
genéticamente para convertirla en
súper-productora
del metabolito de interés. Con relación
a los
cultivos, con NaCl la máxima acumulación
de
carotenoides fue 0,1791 ± 0,01 μg mL-1 (NaCl 0,6
M), de lo
que se puede deducir que la mejor sal para
la
acumulación de carotenoides en Scenedesmus dimorphus
es KNO3, la
cual supera la acumulación de
carotenoides
de los cultivos con NaCl. Como el objetivo
del
presente trabajo es determinar el mejor factor
para
acumular carotenoides, se decidió usar la sal
KNO3 0,6 M,
a pesar de que no fuera la mejor en cuanto
a velocidad específica de crecimiento.
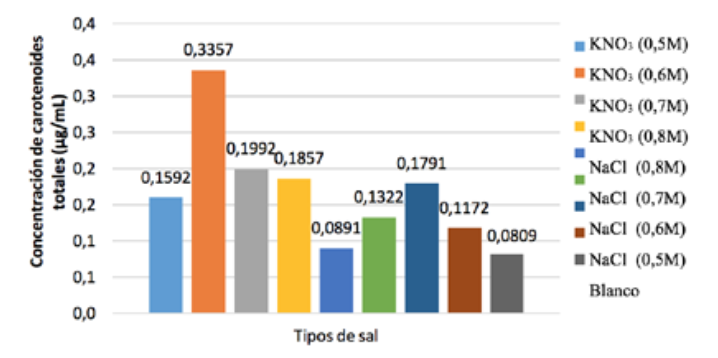 Figura 3
Carotenoides totales de los cultivos con KNO3 y NaCl del pre-experimento
Figura 3
Carotenoides totales de los cultivos con KNO3 y NaCl del pre-experimento
Otro
parámetro a tener en cuenta fue el viraje de coloración
(figura 4),
el cual cambia de verde a amarillo.
Esto se
evidencia para la muestra con KNO3 0,6 M,
siendo este
cambio un indicativo cualitativo de la presencia
de carotenoides.
 Figura 4
Viraje de coloración KNO3 a 0,6M pre-experimento
Fuente: elaboración propia.
Figura 4
Viraje de coloración KNO3 a 0,6M pre-experimento
Fuente: elaboración propia.
Al realizar
el análisis estadístico se obtuvieron los resultados
descritos
en la tabla 4, encontrando que no
existe una
relación entre el factor A (KNO3) y el factor
B (NaCl);
por ende, no tienen el mismo efecto sobre
la
acumulación de carotenoides de los cultivos. Igualmente,
el factor B
(NaCl) acepta la hipótesis nula, la
cual se
fundamenta en que la concentración de esta
sal no
genera un cambio significativo en la concentración
de
carotenoides totales. Por último, el factor A
(KNO3)
acepta la hipótesis alternativa, puesto que la
concentración
de la sal genera un cambio significativo
en la
concentración de carotenoides totales. Estos resultados
apoyan la
decisión de seleccionar la sal KNO3
como la
mejor opción para obtener una mayor acumulación
de
carotenoides totales en la especie de microalga
Scenedesmus dimorphus.
Tabla 4
Análisis por diseño factorial pre-experimento
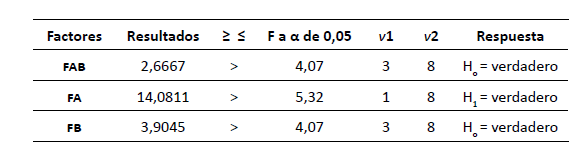 Fuente: elaboración propia.
Fuente: elaboración propia.
Para la
realización del diseño factorial se usó el libro
titulado Handbook of tables for probability and statitiscs,
específicamente la tabla A.6 (Beyer,
1966).
Resultados del experimento
Como se
mencionó, con base en los resultados del
pre-experimento,
se escogió la sal KNO3 0,6M para
la ejecución
del experimento. La figura 5 muestra la
curva del
crecimiento celular, en la que se ve fase de
adaptación
del día 1 al 4; es decir, un día adicional
con
respecto al pre-experimento. La fase exponencial
duró del día
5 al 12, menos que en el pre-experimento,
debido al
aumento en la proporción de nutrientes
del medio.
Finalmente, del día 12 al 15 se desarrolla la
fase
estacionaria antes de la aplicación de la sal. Después
de
adicionar la sal se observó, análogamente al
pre-experimento,
un aumento ligero de la concentración
celular con
respecto al blanco. La microalga siguió
en fase estacionaria después de dicho
aumento.
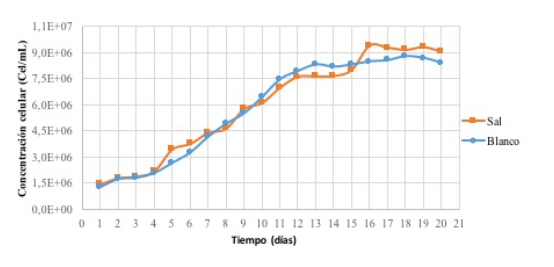 Figura 5
Curva de crecimiento celular del experimento
Figura 5
Curva de crecimiento celular del experimento
La
velocidad de crecimiento para ambos cultivos fue
similar:
0,1675 d-1 para el blanco y 0,1564 d-1 para el
cultivo con
KNO3 0,6 M. Además, el tiempo de duplicación
fue menor
para el cultivo blanco (4,1380 días)
que para el cultivo con sal (4,4322 días).
En cuanto
al análisis espectrofotométrico, el cultivo
con
salinidad alcanzó 0,7395 ± 0,05 μg de carotenoides
mL-1, mientras
el blanco solamente obtuvo 0,1636
± 0,05 μg
mL-1. Asimismo,
se registró un aumento de
0,4038 μg
de carotenoides mL-1 con respecto a lo obtenido
en el pre-experimento.
La máxima
productividad de biomasa la presentó el
cultivo con
KNO3, 0,6M (0,0927 gL-1d-1), mientras que
la del
cultivo blanco fue inferior (0,0538 gL-1d-1). Al
comparar
ambas productividades con lo reportado
por Fonseca
y Guarín (2018), quienes emplearon la
misma
especie de microalga, se puede observar una
diferencia
significativa, puesto que dichos autores obtuvieron
una
productividad total de 0,372 g L-1d-1, aunque
empleando reactores de diferentes geometrías.
Perfil de ácidos grasos
Por medio
de la cromatografía HPLC se encontraron
los
siguientes porcentajes en masa: 21,1 % de ácidos
grasos
monoinsaturados (MUFAS); 43 % de poliinsaturados
(PUFAS) (34
% omega-6 de 34 % y omega-3 de
8,9 %) y
35,9 % de saturados (SFAS). Estos resultados
se muestran en la tabla 5.
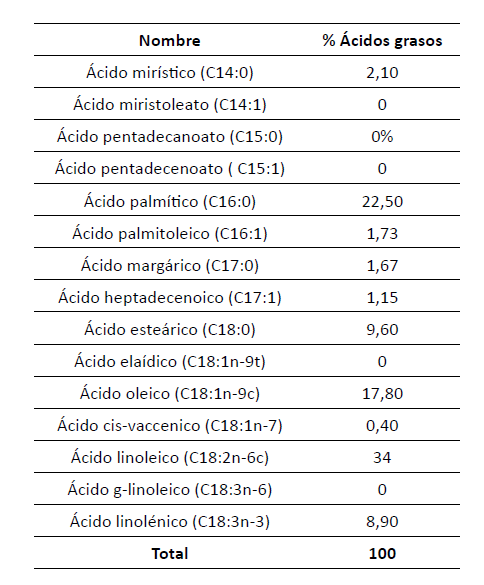 Tabla 5
Perfil lipídico del cultivo con KNO3 a 0,6M en el experimento
Tabla 5
Perfil lipídico del cultivo con KNO3 a 0,6M en el experimento
De los
ácidos poliinsaturados, el ácido linoléico (omega
6) es el
que se encuentra en mayor proporción
(34 %). Por
su parte, de los ácidos monoinsaturados,
el ácido
palmitoleico (omega 7) cuenta con el porcentaje
más alto
(1,73 %). Por último, del total de ácidos
saturados,
el de mayor proporción fue el ácido palmítico
(22,5 %).
CONCLUSIONES
La
salinidad fue seleccionada como el factor de estrés
propicio
para favorecer la generación de carotenoides
en la
especie de microalga Scenedesmus dimorphus.
Luego de
evaluar las sales NaCl y KNO3, se determinó
que la que
más favoreció la acumulación de carotenoides
fue KNO3
0,6M. Al realizar el proceso en un
volumen de
3,53 L, se obtuvieron 0,7395 ± 0,05 μg de
carotenoides
mL-1, un
notorio aumento con respecto
a la
concentración del blanco (0,1636 ± 0,02 μg de carotenoides
mL-1).
Por otra
parte, se produjeron 0,0012 g en peso seco
de
carotenoides y 3 gramos en peso seco de lípidos,
indicando
una proporción de 1:2.500 de carotenoides
a lípidos,
por lo cual la salinidad generó carotenoides
en una
proporción muy baja con respecto a
los lípidos.
A partir de este resultado, se concluye que
es poco
factible usar este cultivo para la producción a
gran escala
de carotenoides naturales, aunque no se
descarta su
aptitud para la producción de lípidos, sobre
todo de
omega 6, como lo indica el perfil lipídico.
Dicho
perfil lipídico mostró un porcentaje de 21,1 %
de MUFAS,
43 % de PUFAS y 35,9 % de SFAS, con un contenido
de omega-6 (34 %) y omega-3 (8,9 %).
Con relación
a otros autores, la productividad de biomasa
en el
presente trabajo fue relativamente baja,
siendo
0,0927 gL-1día-1 para KNO3 0,6M. Sin embargo,
esta
aumentó con respecto al blanco, el cual llegó a
0,0538 gL-1día-1.
Para
futuras investigaciones se recomienda analizar y
evaluar la
influencia combinada de estrés nutricional
y lumínico
en la generación de carotenoides totales
en la especie Scenedesmus
dimorphus.
Referencias
Acevedo, A., & Ramírez, J. (2003). Influencia de un gradiente cruzado de luz y temperatura en la morfología de Scenedesmus acutus meyen var. globosus hortobágyi y sus implicaciones taxonómicas. Actual Biology, 25(79), 141-146.
Beyer, W. H. (1966). Handbook of tables for probability and statistics. Cleveland: The chemical Rubber Co.
Dhaka, P., & Singh, G. P. (2018). Effect of pH on growth and biopigment accumulation of green alga Dunaliella salina. International Journal of Pharmaceutical Sciences and Research, 9(1), 271-
Forján-Lozano,
E., Garbayo-Nores, I., Casal-Bejarano,
C.,
& Vílchez-Lobato, C. (2007). Enhancement
of carotenoid production in
Nannochloropsis by
phosphate and sulphur limitation. Communicating
Current Research and Educational Topics
and
Trends in Applied Microbiology.
Universidad de
Huelva, España.
Fernández-Cordero,
B. (2013). Producción de
carotenoides por microalgas y caracterización de
la ruta carotenogénica en Chlorella zofingiensis
(Tesis
doctoral, Departamento de Ingeniería
Química).
Universidad de Sevilla, Sevilla, España.
Fonseca,
L. A., & Guarín, M. P. (2018). Evaluación de la
remoción de cromo con cultivos de microalgas en
un fotobiorreactor de panel plano (Tesis de grado,
Ingeniería
Química). Fundación Universidad de
América,
Bogotá, Colombia.
Fu, W., Guðmundsson, Ó., Paglia,
G., Herjólfsson, G.,
Andrésson, Ó. S., Palsson, B. Ø.,
& Brynjólfsson, S.
(2013). Enhancement of
carotenoid biosynthesis
in the green microalga
Dunaliella salina with lightemitting
diodes and adaptive laboratory
evolution.
Applied microbiology and biotechnology, 97(6),
2395-2403.
López, J. A., Fimbres-Olivarría,
D., Medina-Juárez, L.
A.,
Miranda-Baeza, A., Martínez-Córdova, M. L.,
&
Molina-Quijada, D. M. A. (2013). Producción de
biomasa
y carotenoides de Dunaliella tertiolecta
en
medios limitados en nitrógeno. Phyton, 82(1),
23-30.
López,
Y. K. (2008). Caracterización genética y de
metabolitos secundarios de diferentes aislamientos
de Dunaliella salina bajo condiciones de estrés
salino (Trabajo
de Grado de Maestría en Ciencias
en
Biotecnología Genómica). Instituto Politécnico
Nacional,
Universidad de México, México.
Moronta,
R., Mora, R., & Morales, E. (2006).
Respuesta
de la microalga Chlorella sorokiniana
al
pH, salinidad y temperatura en condiciones
axénicas
y no axénicas. Revista de la Facultad de
Agronomía, 23(1),
27-41.
Murcia,
M., J., L., & Parra M, M. A. (2018). Producción
de proteínas a partir de la microalga Chlorella
vulgaris enriqueciendo el medio de cultivo con
fuentes de nitrógeno (Tesis
de grado, Ingeniería
Química).
Fundación Universidad de América,
Bogotá,
Colombia.
Plaza,
M., Herrero, M., Cifuentes, A., & Ibanez, E.
(2009). Innovative natural
functional ingredients
from microalgae. Journal of agricultural and food
chemistry, 57(16), 7159-7170.
Přibyl, P., Pilný, J., Cepák,
V., & Kaštánek, P. (2016). The
role of light and nitrogen in
growth and carotenoid
accumulation in Scenedesmus sp. Algal research,
16,
69-75.
Restrepo,
T. I., Díaz, G. J., & Pardo, S. C. (2012). Peces
dulceacuícolas
como alimento funcional: perfil
de
ácidos grasos en tilapia y bocachico criados
en
policultivo. Revista de biotecnología Unicauca,
10(2),
44-53.
Rubio,
F., D., Sandoval, J. A., Ruíz, J. P., & Tovar, J. C.
(2017).
Escalamiento de un fotobiorreactor a nivel
piloto
para la producción de biomasa. Revista de
Investigación, 10(1),
61-72.
Vega,
B. O. A., & Voltolina, D. (2007). Concentración,
recuento celular y tasa de crecimiento. En Métodos
y herramientas analíticas en la evaluación de
la biomasa microalgal (pp.
17-25). Ciudad de
México:
conacyt.
Velázquez,
J. (2012). Problemas de salud ocasionados
por los aditivos, preservativos, colorantes y
sabores artificiales, hormonas y antibióticos en
la alimentación industrial del mundo moderno.
Universidad
Interamericana de Puerto Rico.
Wichuk, K., Brynjólfsson, S.,
& Fu, W. (2014).
Biotechnological production of
value-added
carotenoids from microalgae:
Emerging technology
and prospects. Bioengineered, 5(3),
204-208.




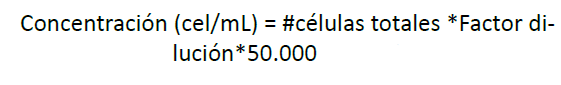 [Ecuación 1]
[Ecuación 1]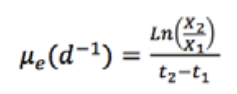 [Ecuación 2]
[Ecuación 2]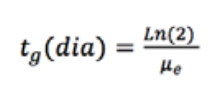 [Ecuación 3]
[Ecuación 3]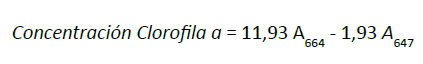 [Ecuación 6]
[Ecuación 6]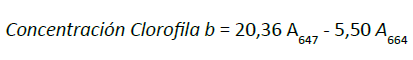 [Ecuación 7]
[Ecuación 7]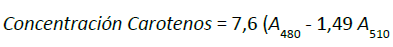 [Ecuación 8]
[Ecuación 8] [Ecuación 9]
[Ecuación 9]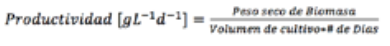 [Ecuación 10]
[Ecuación 10]









