Artículos Científicos
REMOCIÓN DE TARTRAZINA EN AGUA USANDO NANOPARTÍCULAS DE HIERRO CEROVALENTES
REMOVAL OF TARTRAZINE IN WATER USING ZERO-VALENT IRON NANOPARTICLES
REMOCIÓN DE TARTRAZINA EN AGUA USANDO NANOPARTÍCULAS DE HIERRO CEROVALENTES
infoANALÍTICA, vol. 7, núm. 2, 2019
Pontificia Universidad Católica del Ecuador
Recepción: 01 Mayo 2019
Aprobación: 18 Junio 2019
Resumen: Debido a la importancia de una alternativa en decoloración de aguas residuales provenientes de la industria de alimentos, se reporta la remoción del colorante tartrazina, utilizando nanopartículas de hierro cerovalentes. Las nanopartículas se prepararon por reducción química de cloruro férrico con borohidruro de sodio en medio inerte. Para evaluar la remoción, se emplearon concentraciones de 25, 50 100, 150 y 200 mg/L de nanopartículas, con tiempos de contacto en agua de 10, 20 y 30 minutos a pH de 3, 5, 7, 9 y 11. Las nanopartículas obtenidas se caracterizaron por Microscopía Electrónica de Barrido (SEM, por sus siglas en inglés) y Espectrómetro de Dispersión de Rayos X (EDX, por sus siglas en inglés). Como resultados se obtuvieron nanopartículas de 53,3 y 92,1 nm aproximadamente. Se verificó la remoción de los colorantes en agua por Espectrofotometría UV-Vis e Infrarrojos con Transformada de Fourier (FT-IR). Los parámetros óptimos para la remoción de tartrazina, se lograron empleando 200 mg/L de nanopartículas, 30 minutos de agitación y pH 3 con una eficiencia del 83,3 %. Se logró una adsorción de tartrazina de hasta 301 mmol/100g (1659 mg/g). Se concluye que el uso de nanopartículas de hierro cerovalentes, es adecuado para la remoción del colorante tartrazina en agua.
Palabras clave: nanopartículas de hierro cerovalentes, remoción, colorante, tartrazina.
Abstract: Due to the importance of an alternative to the decolorization of wastewater from the food industry, the removal of tartrazine dye is reported, using zero-valent iron nanoparticles. The nanoparticles were prepared by chemical reduction of ferric chloride with sodium borohydride in an inert medium. To evaluate the removal, concentrations of 25, 50, 100, 150 and 200 mg/L of nanoparticles were used, with contact times in water of 10, 20 and 30 minutes at pH of 3, 5, 7, 9 and 11. Scanning Electron Microscopy (SEM) and Energy Dispersive X-ray Spectroscopy (EDX) was used to characterize the nanoparticles obtained. As result, zero valent iron nanoparticles were obtained with an average size of 53.3 y 92.1 nm approximately. UV-Vis and Infrared Spectrophotometry with Fourier Transform (FT-IR) was used to verify the removal of the dye in water. The optimal parameters for the removal of tartrazine were given using 200 mg/L of nanoparticles, 30 minutes of agitation and pH 3 with an efficiency of 83.3 %. An adsorption of tartrazine of up to 301 mmol/100g (1659 mg/g) was achieved. It is concluded that zero valent iron nanoparticles are suitable for removal of tartrazine in water. INTRODUCCIÓN
Keywords: iron zero valent nanoparticles, removal, dye, tartrazine.
INTRODUCCIÓN
El agua residual producida por la industria de alimentos, es un peligro potencial para el sistema de agua natural (Deepali, 2012). El agua residual contiene una gran cantidad de sustancias inorgánicas y orgánicas, que son tóxicas para las diversas formas de vida del ecosistema (Spina et al., 2012). El tratamiento de aguas residuales puede implicar procesos físicos, químicos o biológicos o combinaciones de estos, en función de los estándares de salida requeridos.
El color en el efluente es uno de los más notables indicadores de contaminación del agua. Los colorantes son estables, recalcitrantes, e incluso potencialmente carcinogénicos y tóxicos. Su liberación en medio ambiente crea serios problemas ambientales y de salud. Por lo tanto, los efluentes industriales cargados de colorantes son una preocupación cada vez mayor y necesitan ser eficazmente tratados antes de ser vertidos para prevenir peligros potenciales. Los colorantes sintéticos son el grupo de los contaminantes más peligrosos en el agua. Estos reducen la penetración de la luz a través de la superficie del agua, lo que impide la fotosíntesis de la flora acuosa (Gonawala & Mehta, 2014).
La tartrazina, por ejemplo, es un colorante sintético monoazoico, soluble en agua, que presenta enlaces N=N y C=N como grupos cromóforos, y ácido sulfónico como grupo auxocromo (Figura 1).
Su inocuidad, ingesta alimentaria y especificaciones se evaluaron en la 82ª reunión del Comité Mixto FAO/OMS de Expertos en Aditivos Alimentarios (JECFA). Su presentación como sal trisódica, es conocida como Amarillo 5 y es usada principalmente en la industria alimenticia (FDA, 2018). Puede causar reacciones alérgicas en individuos sensibles, incluso en niveles de dosis de ingesta diaria aceptable de 7,5 mg/kg de peso corporal (König, 2015). De todos los colorantes azoicos, la tartrazina es la más alergénica y, en particular, provoca reacciones asmáticas a las personas con intolerancia a la aspirina. Los síntomas de la hipersensibilidad a la tartrazina pueden ocurrir por ingestión o exposición cutánea, y los efectos pueden incluir ansiedad, migraña, depresión, visión borrosa, picazón, debilidad general, sensación de calor, sensación de sofocación, parches de piel púrpura y trastornos del sueño (Choulis, 2010). De acuerdo con otros autores los efectos toxicológicos de la tartrazina no incluyen carcinogenicidad (Borzelleca & Hallagan, 1988; Maekawa et al., 1987; Moutinho et al., 2007; Poul et al., 2009).
La eliminación de los colorantes en aguas residuales se logra mediante procesos de oxidación (Forgacs et al., 2004). Estos comprenden la ozonización o procesos de oxidación avanzada para la decoloración, incluidos: la oxidación fotocatalítica, y el tratamiento electroquímico u ozonización combinada con radiación ultravioleta (UV). Los métodos de decoloración no oxidativa pueden ser la adsorción, biodegradación, coagulación e irradiación ultrasónica (Aksu et al., 2008; Forgacs et al., 2004; Fu & Viraraghavan, 2001).
Entre los métodos de tratamiento, el proceso de adsorción de colorantes usando nanopartículas de hierro cerovalentes, proporciona una atractiva alternativa para controlar los diversos contaminantes en aguas residuales (Raman & Kanmani, 2016).
Las nanopartículas de hierro cerovalentes, simbolizadas como FeNPs, están constituidas de Fe0 y tienen un tamaño menor a 100 nm. Éstas se han convertido en el reductor metálico más común debido a su abundancia, baja toxicidad, bajo costo y efectividad (Ahuja et al., 2016). El proceso de decoloración (Raman & Kanmani, 2016) usando este tipo de nanopartículas, comprende las siguientes etapas:
a) Difusión del colorante de la solución a la superficie de la nanopartícula.
b) Adsorción del colorante sobre la superficie de la nanopartícula.
c) Transferencia de electrones de la nanopartícula al colorante. Proceso de reducción, para dar origen a productos intermedios.
d) Difusión y desorción del colorante.
Varios estudios se han realizado respecto a la remoción de colorantes sintéticos en agua, usando nanopartículas de hierro cerovalentes (Bigg & Judd, 2002; Nam & Tratnyek, 2000), sin embargo, la remoción de tartrazina, no ha sido ampliamente reportada usando este tipo de nanopartículas (Mao et al., 2015; Sohrabi et al., 2014; Zhao et al., 2008).
Considerando la importancia de la remoción de un colorante sintético potencialmente alergénico como la tartrazina, en este estudio se reporta las condiciones óptimas para su remoción usando nanopartículas de hierro cerovalente.
MATERIALES Y MÉTODOS
Síntesis de nanopartículas de hierro cerovalente (FeNPs)
Las nanopartículas de hierro cerovalentes se sintetizaron por reducción del cloruro férrico (FeCl3) (Fisher Scientific® 99.9%) con borohidruro de sodio (NaBH4) (Merck® 99.9%), siguiendo el método propuesto por Sun et al. (2006). Se prepararon 100 mL de una solución de FeCl3 0,6 M. La solución se colocó en un balón de fondo plano de 250 mL y se adicionaron 25 mL de etanol y 5 mL de agua destilada. Paralelamente, se colocaron 100 mL de una solución NaBH4 0,8 M en un embudo de separación de 100 mL. Desde el embudo se añadió la solución de NaBH4 a la del cloruro férrico con velocidad controlada de una gota por segundo. La mezcla se mantuvo en agitación constante a 400 rpm por 30 minutos bajo atmósfera inerte de helio. Utilizando un superimán de neodimio (NdFeB Supermagnete®) las nanopartículas se separaron de la fase acuosa y se lavaron cuatro veces utilizando agua desionizada y etanol absoluto en porciones de 15 mL cada una. En cada lavado, se colocó el balón en un baño de ultrasonido (Branson ® 3510) por 10 minutos.
Caracterización de nanopartículas
Para determinar el tamaño de nanopartículas obtenidas, se empleó un microscopio de barrido electrónico SEM-EDX (Phenom ProX®). Para el análisis, cada muestra fue colocada sobre un pin de carbono y recubierta con oro como material conductor durante cinco minutos, usando el equipo RotaryPumped Sputter® Coater/Carbon Coater Q150R ES. El análisis infrarrojo se realizó usando un Espectrofotómetro de Infrarrojo (Perkin Elmer® Spectrum BX).
Remoción del colorante tartrazina
La remoción de tartrazina en agua se llevó a cabo siguiendo el protocolo propuesto por Alamillo (2013). Se preparó una solución stock de tartrazina de 75 ppm. Se evaluó el efecto de la concentración de nanopartículas, tiempo de contacto y pH. Para la determinación de la concentración de nanopartículas, se colocaron 10 mL de la solución de stock de tartrazina y concentraciones de 25, 50, 100, 150 y 200 mg/L de FeNPs, respectivamente. Cada tubo se agitó por 30 minutos en un vórtex (Daigger®, modelo Genie 2). Para analizar el efecto del pH en la remoción, se prepararon cinco tubos de ensayo y se agregaron 10 mL de la solución stock de tartrazina a cada uno. Se modificó el pH a 3, 5, 7, 9 y 11 usando HCl 0,1M y NaOH 0,1M. Se agitó en el vórtex y se dejó reposar por 30 minutos. Cada análisis se repitió diez veces. Se tomaron alícuotas de 2 mL cada 10 minutos para analizarlas por Espectroscopía UV-Visible (Agilent Technologies® Cary 60). El sólido decantado fue analizado por Espectroscopía de Infrarrojos FT-IR.
Concentración residual de tartrazina
La eficiencia de la remoción de colorante se calculó utilizando la siguiente ecuación:
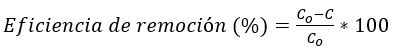 (1)
(1)En donde Co es la concentración inicial de colorante, mientras que C es la concentración final de colorante luego de la remoción, ambos en mg/L.
La adsorción se expresa en mmol adsorbida de tartrazina por cada cien gramos de FeNPs y se determinó mediante la siguiente ecuación:
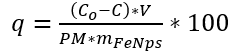 (2)
(2)En donde V es el volumen de solución que se está haciendo la remoción (0,010 L), mFeNPs que indica los gramos de FeNPs que están realizando la remoción en el volumen V y PM que corresponde al peso molecular de la tartrazina.
RESULTADOS
La imagen SEM de las FeNPs obtenidas, se muestra en la Figura 2.

En la Figura 3, se muestra el espectro EDX de las FeNPs y en la Tabla 1, se indica el porcentaje de cada elemento químico presente en la muestra.
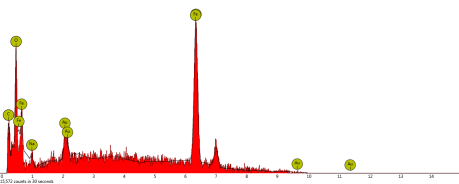
| Símbolo | Nombre | % |
| Fe | Hierro | 86,2 |
| O | Oxígeno | 6,1 |
| Au | Oro | 6,2 |
| C | Carbono | 0,5 |
| Na | Sodio | 1,0 |
En la Figura 4, se muestra el espectro FT-IR de las FeNPs (a), tartrazina (b) y FeNPs-tartrazina (c).
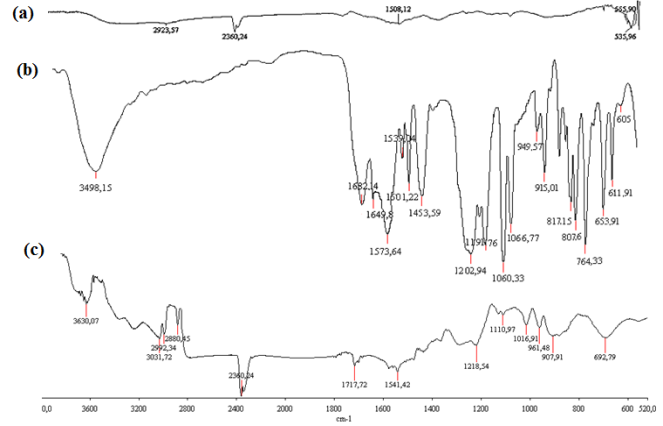
En la Figura 5, se muestra el espectro UV-Vis de la tartrazina.
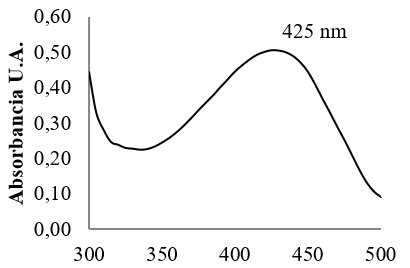
En la Figura 6, se muestra el efecto de la concentración de FeNPs sobre de la remoción de tartrazina del agua.
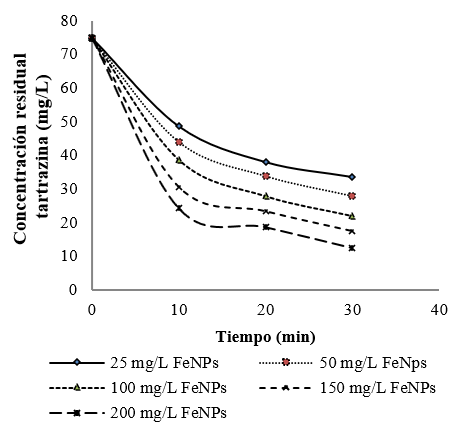
En la Figura 7, se observa el efecto del pH sobre de la remoción de tartrazina del agua.
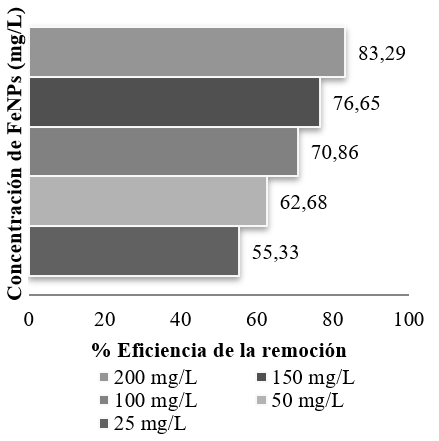
En la Figura 8, se muestra el porcentaje de eficiencia de la remoción de tartrazina del agua usando la ecuación (1).
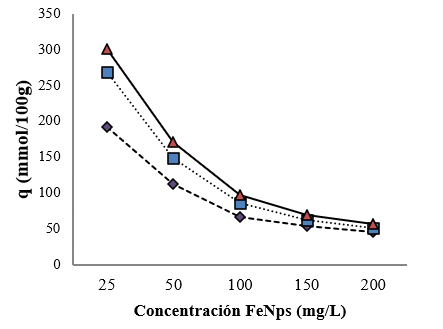
En la Figura 9, se muestra la adsorción de tartrazina en las FeNPs usando la ecuación (2).
DISCUSIÓN
El tamaño de las FeNPs estimadas por SEM, fue de 53,3 y 92,1 nm aproximadamente. No fue posible realizar un histograma de frecuencias de tamaño de nanopartículas, debido a la resolución del equipo. La composición elemental analizada por SEM-EDX indica que el elemento mayoritario es efectivamente hierro en un 86,2%, tal como se evidenció en la Tabla 1. La presencia de oxígeno puede deberse a un proceso de oxidación dado momento de secar la muestra para el análisis elemental. El sodio puede provenir del material de vidrio empleado.
En el análisis infrarrojo de la Figura 4a, se observa en el espectro de las FeNPs, la primera banda sobre los 500 cm-1, que corresponde al enlace de estiramiento Fe-O de los óxidos de hierro que se encuentran en la coraza de las nanopartículas de hierro cerovalentes (Lin et al., 2010). El espectro IR de tartrazina (Figura 4b) presenta la banda característica del grupo azo (N=N) a 1573,63 cm-1. Las vibraciones características de estiramiento del enlace –OH están presentes entre los 3200 a 3600 cm-1, mientras que la banda del ácido sulfónico se ubicó a 1060,33 cm-1. Las bandas entre los 1400 a 1600 cm-1 corresponden a las vibraciones entre C=C de los enlaces bencénicos (Leulescu et al., 2018). En el espectro correspondiente a FeNPs-tartrazina (Figura 4c), se observa la ausencia del pico principal del grupo azo (N=N) lo cual se asocia a la ruptura de este enlace; también se puede evidenciar un nueva pico formado a 2360,24 cm-1 que representa el movimiento tensión de aminas primarias formadas, debido a la ruptura del enlace del grupo azo (He et al., 2012). El estudio de la remoción de tartrazina usando FeNPs, analizado por espectrofotometría UV-Vis, se realizó a 425 nm de acuerdo al máximo de absorción del colorante, mostrado en la Figura 5. La Figura 6, muestra el efecto de la concentración de FeNPs sobre la remoción de la tartrazina, donde podemos observar que una concentración de FeNPs de 200 mg/L fue la más efectiva.
Respecto al efecto del pH en el sistema (Figura 7), el medio ácido fue el mejor para la remoción, con una concentración residual de 7,9 mg/L; resultados que concuerdan con los reportados por Fan et al. (2009), el cual concluye que la remoción de un colorante aumenta a pH ácido y neutro, mientras que a pH básico la remoción disminuye.
En la Figura 8, referente al porcentaje de eficiencia de remoción, se observa que empleando 200 mg/L de FeNPs y un tiempo de contacto de 30 minutos, se obtuvo la menor concentración residual de colorante, 12,5 mg/L, con una eficiencia máxima de 83,3%. Resultados que concuerdan con los publicados por He et al. (2012) los cuales concluyen que mientras mayor es la concentración de FeNPs, mayor es su eficiencia al remover colorantes azoicos hasta su saturación máxima.
A pesar de la mayor eficiencia observada en la remoción de tartrazina, en presencia de una mayor concentración de FeNPs (200 mg/L) y mayor tiempo de contacto (30 min), en la Figura 9 se observa una importante influencia de ambas variables en la adsorción. Es notorio que, si se mantiene el mismo tiempo de contacto y se aumenta las concentraciones de FeNPs, la adsorción disminuye. La literatura reporta, que este comportamiento puede estar asociado a la aglomeración de FeNPs, lo cual disminuye la presencia de los sitios activos disponibles para el proceso de adsorción (Das, 2018; Tran, 2018). De la misma manera, mientras mayor es el tiempo de contacto y menor la concentración de FeNPs, el colorante presenta la mayor adsorción. Este proceso es gobernado por una cinética de pseudo segundo orden (Hu, 2017). La mayor adsorción (301 mmol/100g o 1659 mg/g) se registra con una concentración de FeNPs de 25 mg/L y un tiempo de 30 min. En el punto de mayor remoción de colorante, es decir a 200 mg/L de FeNPs y 30 min de contacto, se presentó una adsorción de 56 mmol/100 g (308 mg/g). Es evidente que a medida que aumenta la concentración de FeNPs el tiempo de contacto deja de ser una variable que afecta la adsorción, presentando casi el mismo valor de q (fracción de superficie cubierta por el adsorbato), cuando hay 200 mg/L de FeNPs. El valor de adsorción encontrado para la remoción de tartrazina en este estudio es superior respecto a otras tecnologías, como por ejemplo las que utilizan nanotubos de carbonos (84 mg/g) (Goscianska, 2015) o nanocompositos de Fe3O4 (775,2 mg/g) (Hu, 2017). La literatura reporta que la remoción de tartrazina en nanopartículas de Fe3O4 a pH 3. Este resultado se ajusta adecuadamente al modelo de Langmuir, sugiriendo la formación de una monocapa caracterizada por la adsorción selectiva mediante un mecanismo de neutralización de cargas (Mateus, 2018).
CONCLUSIÓN
El uso de FeNPs, logró hasta un máximo de remoción de tartrazina de 83,3 %. Este efecto se observó a una concentración de 200 mg/L de FeNPs y un tiempo de contacto de 30 minutos. Sin embargo, mientras aumenta la concentración de FeNPs, disminuye la adsorción. La mayor adsorción registrada fue de 301 mmol/100g (1659 mg/g) a la menor concentración evaluada y el mayor tiempo de contacto, lo cual indica que el aumento de la concentración FeNPs puede provocar la disminución de sus sitios activos por efecto de la saturación.
Agradecimientos
Un agradecimiento especial a la Dra. Mónica Pérez Cabero y al Instituto Tecnológico del Plástico-AIMPLAS España por el análisis SEM-EDX realizado.
Referencias
Ahuja, N., Chopra, A. K., & Ansari, A. A. (2016). Removal of Colour from Aqueous Solutions by using Zero Valent Iron Nanoparticles. Journal of Environmental Science, Toxicology and Food Technology (IOSR-JESTFT), 10(1), 4–14.
Aksu, Z., Tatlı, A. İ., & Tunç, Ö. (2008). A comparative adsorption/biosorption study of Acid Blue 161: Effect of temperature on equilibrium and kinetic parameters. Chemical Engineering Journal, 142(1), 23–39.
Alamillo, V. (2013). Remoción de colorantes orgánicos azul índigo y tartrazina, en solución acuosa, empleando nanopartículas de hierro soportadas en piedra volcánica de óxido de hierro (tezontle)(Tesis de pregrado). Toluca de Lerdo, México.
Bigg, T., & Judd, S. J. (2002). Reductive degradation of azo dyes in aqueous solution by zero-valent iron. IAHS PUBLICATION, 383–390.
Borzelleca, J. F., & Hallagan, J. B. (1988). Chronic toxicity/carcinogenicity studies of FD & C Yellow No. 5 (tartrazine) in rats. Food and Chemical Toxicology, 26(3), 179–187.
Choulis, N. H. (2010). Miscellaneous drugs, materials, medical devices, and techniques. In Side Effects of Drugs Annual, 32, 891–902. Elsevier.
Das, S., Dash, S. K., & Parida, K. M. (2018). Kinetics, Isotherm, and Thermodynamic Study for Ultrafast Adsorption of Azo Dye by an Efficient Sorbent: Ternary Mg/(Al + Fe) Layered Double Hydroxides. ACS Omega, 3(3), 2532–2545.
Deepali, N. J. (2012). Study of ground water quality in and around SIDCUL industrial area, Haridwar, Uttarakhand, India. Journal of Applied Technology in Environmental Sanitation, 2(2), 129–134.
Fan, J., Guo, Y., Wang, J., & Fan, M. (2009). Rapid decolorization of azo dye methyl orange in aqueous solution by nanoscale zerovalent iron particles. Journal of Hazardous Materials, 166(2–3), 904–910.
FDA, (2018) Listing of color additives subject to certification. 21 C.F.R. §74.705.
Forgacs, E., Cserháti, T., & Oros, G. (2004). Removal of synthetic dyes from wastewaters: a review. Environment International, 30(7), 953–971.
Fu, Y., & Viraraghavan, T. (2001). Fungal decolorization of dye wastewaters: a review. Bioresource Technology, 79(3), 251–262.
Gonawala, K. H., & Mehta, M. J. (2014). Removal of Color from Different Dye Wastewater by Using Ferric Oxide as an Adsorbent. Int. Journal of Engineering Research and Applications, 4(5), 102–109.
Goscianska, J., & Pietrzak, R. (2015). Removal of tartrazine from aqueous solution by carbon nanotubes decorated with silver nanoparticles. Catalysis Today, 249, 259–264.
He, Y., Gao, J. F., Feng, F. Q., Liu, C., Peng, Y. Z., & Wang, S. Y. (2012). The comparative study on the rapid decolorization of azo, anthraquinone and triphenylmethane dyes by zero-valent iron. Chemical Engineering Journal, 179, 8–18.
Hu, D., Wan, X., Li, X., Liu, J., & Zhou, C. (2017). Synthesis of water-dispersible poly-L-lysine-functionalized magnetic Fe3O4-(GO-MWCNTs) nanocomposite hybrid with a large surface area for high-efficiency removal of tartrazine and Pb(II). International Journal of Biological Macromolecules,105(2), 1611–1621.
König, J. (2015). Food colour additives of synthetic origin. In M. J. Scotter (Ed.), Colour Additives for Foods and Beverages, 36–60. Woodhead Publishing.
Leulescu, M., Rotaru, A., Pălărie, I., Moanţă, A., Cioateră, N., Popescu, M., … Rotaru, P. (2018). Tartrazine: physical, thermal and biophysical properties of the most widely employed synthetic yellow food-colouring azo dye. Journal of Thermal Analysis and Calorimetry, 134(1), 209–231.
Lin, Y. H., Tseng, H. H., Wey, M. Y., & Lin, M. D. (2010). Characteristics of two types of stabilized nano zero-valent iron and transport in porous media. Science of the Total Environment, 408(10), 2260–2267.
Maekawa, A., Matsuoka, C., Onodera, H., Tanigawa, H., Furuta, K., Kanno, J., … Ogiu, T. (1987). Lack of carcinogenicity of tartrazine (FD & C Yellow No. 5) in the F344 rat. Food and Chemical Toxicology, 25(12), 891–896.
Mao, Y., Xi, Z., Wang, W., Ma, C., & Yue, Q. (2015). Kinetics of solvent blue and reactive yellow removal using microwave radiation in combination with nanoscale zero-valent iron. Journal of Environmental Sciences, 30, 164–172.
Mateus, G. A. P., dos Santos, T. R. T., Sanches, I. S., Silva, M. F., de Andrade, M. B., Paludo, M. P., … Bergamasco, R. (2018). Evaluation of a magnetic coagulant based on Fe3O4 nanoparticles and Moringa oleifera extract on tartrazine removal: coagulation-adsorption and kinetics studies. Environmental Technology, 1, 1-16.
Merck KGaA. (2019). Tartrazine. Retrieved from https://www.sigmaaldrich.com/catalog/product/sigma/t0388?lang=en®ion=EC
Moutinho, I., Bertges, L., & Assis, R. (2007). Prolonged use of the food dye tartrazine (FD&C yellow n° 5) and its effects on the gastric mucosa of Wistar rats. Brazilian Journal of Biology, 67(1), 141–145.
Nam, S., & Tratnyek, P. G. (2000). Reduction of azo dyes with zero-valent iron. Water Research, 34(6), 1837–1845.
Poul, M., Jarry, G., Elhkim, M. O., & Poul, J.-M. (2009). Lack of genotoxic effect of food dyes amaranth, sunset yellow and tartrazine and their metabolites in the gut micronucleus assay in mice. Food and Chemical Toxicology, 47(2), 443–448.
Raman, C. D., & Kanmani, S. (2016). Textile dye degradation using nano zero valent iron: A review. Journal of Environmental Management, 177, 341–355.
Sohrabi, M. R., Amiri, S., Masoumi, H. R. F., & Moghri, M. (2014). Optimization of Direct Yellow 12 dye removal by nanoscale zero-valent iron using response surface methodology. Journal of Industrial and Engineering Chemistry, 20(4), 2535–2542.
Spina, F., Anastasi, A. E., Prigione, V. P., Tigini, V., & Varese, G. (2012). Biological treatment of industrial wastewaters: a fungal approach.
Sun, Y. P., Li, X. Q., Cao, J., Zhang, W. X., & Wang, H. P. (2006). Characterization of zero-valent iron nanoparticles. Advances in Colloid and Interface Science, 120(1–3), 47–56.
Tran, H. V, Tran, T. L., Le, T. D., Le, T. D., Nguyen, H. M. T., & Dang, L. T. (2018). Graphene oxide enhanced adsorption capacity of chitosan/magnetite nanocomposite for Cr(VI) removal from aqueous solution. Materials Research Express, 6(2), 025018.
Zhao, Z., Liu, J., Tai, C., Zhou, Q., Hu, J., & Jiang, G. (2008). Rapid decolorization of water soluble azo-dyes by nanosized zero-valent iron immobilized on the exchange resin. Science in China Series B: Chemistry, 51(2), 186–192.
Notas