Artículos Científicos
EVALUACIÓN DE MIGRACIÓN DE ALUMINIO DURANTE LA COCCIÓN DE ARROZ BLANCO EN OLLAS DE ALUMINIO.
EVALUATION OF MIGRATED ALUMINIUM IN THE COOKING OF WHITE RICE IN THE ALUMINIUM POTS.
EVALUACIÓN DE MIGRACIÓN DE ALUMINIO DURANTE LA COCCIÓN DE ARROZ BLANCO EN OLLAS DE ALUMINIO.
infoANALÍTICA, vol. 7, núm. 2, 2019
Pontificia Universidad Católica del Ecuador
Recepción: 30 Abril 2019
Aprobación: 19 Junio 2019
Resumen: Diariamente en los hogares ecuatorianos se utilizan ollas de aluminio para cocinar, sin saber la cantidad de residuos metálicos que se transfiere a los alimentos. Este trabajo evaluó la migración del aluminio en la cocción de arroz blanco (Oryza sativa L.) en recipientes de éste material. Se trabajó con seis tipos de ollas, de diferentes marcas comerciales de mayor presencia en el mercado, en éstas se realizó la cocción del alimento por 15 minutos. De cada unidad experimental se tomaron 50,0 gramos de muestra y, luego de secar, se calcinó para obtener cenizas totales que fueron sometidas a un proceso de digestión ácida. La cuantificación de aluminio se realizó mediante la técnica de absorción atómica con llama de óxido nitroso–acetileno. Se realizaron cinco ciclos de trabajo secuenciales con cada recipiente, los resultados obtenidos se compararon con el límite máximo permisible de 1 mg Al/kg de alimento establecido por la OMS y la Unión Europea. Se pudo observar que luego de la tercera cocción, la migración de aluminio baja hasta valores inferiores al límite máximo permisible excepto en una de las muestras. El estudio permite concluir que la migración de éste metal va disminuyendo con el número de usos en las condiciones experimentales descritas.
Palabras clave: Ollas, Aluminio, Absorción Atómica, Migración, Uso doméstico.
Abstract: Every day in the Ecuadorian households aluminum cooking pots are used for cooking, without knowing haw much the metallic waste that is transferred to the food. This work focused to evaluate the migration of aluminum transferred during the cooking of white rice (Oryza sativa L.) in the aluminium pots. It has warked with six types of pots from different trademarks of greater presence in the market. In these the food was cooked for 15 minutes. From each experimental unit 50.0 grams of sample were taken and, after drying, it was calcined to obtain total ashes. These were subjected to the acid digestion process. The aluminum quantification was carried by the atomic absorption technique with nitrous oxide-acetylene flame. Five sequential work cycles were carried out with each container. The results obtained were compared with the maximum permissible limit of 1 mg Al/kg of food established by the WHO and the European Union. It was observed that after the third work cycle the migration of aluminum decrease below acceptable level except in one of the samples. The study allows to conclude that the migration of this metal is decreasing with the number of uses in the experimental conditions described. INTRODUCCIÓN
Keywords: Pots, Aluminium, Atomis Absorbtion, Migration, Domestic use.
INTRODUCCIÓN
El debate sobre la relación entre los niveles de aluminio y la enfermedad de Alzheimer (EA) dura desde 1965, cuando se demostró que inoculación de fosfato de aluminio en conejos dio lugar a una degeneración neurofibrilal (Flaten, 2001)
Los primeros estudios epidemiológicos intencionados en relacionar los niveles de aluminio en agua potable con EA se realizaron en Noruega. Mas adelante otros estudios confirmaron esta asociación (Tabla 1).
Según Lopez (López et al., 2000), la ingesta media de aluminio corresponde a unos 30 mg al día. Por otro lado, según la Organización Mundial de la Salud (Organization World Health, 2010), la ingesta diaria de aluminio en adultos varía entre los diferentes países: 1,9 a 2,4 mg/día en Australia, 3,9 mg/día en Reino Unido, 6,7 mg/día en Finlandia, 8 a 11 mg/día en Alemania y 6,5 mg/día en los Estados Unidos.
| Estudio nº | País de origen | Resultado |
| 1 | Noruega | + |
| 2 | Reino Unido | - |
| 3 | Canada Newfoundland | + |
| 5 | Canada, Quebec | + |
| 6 | Suecia | - |
| 7 | Francia | + |
Comunmente se admite que el aluminio es un agente causal en encefalopatia por dialisis en algunos pacientes con insuficiencia renal crónica (Schifman & Luevano., 2018). Esta situación se presenta debido a la acumulación tisular de este elemento, como componente de dialisis, en el torrente sanguineo y la falta de función renal de estos pacientes, que es la vía principal de excreción de aluminio.
En la población en general, cualquier trastorno relacionado con la toxicidad de aluminio se deba a una acumulación lenta durante un largo periodo de tiempo.
En 1989, la FAO/OMS presentó un informe estableciendo del límite máximo provisional para la ingesta semanal de aluminio, (PTWI-Provisional Tolerable Weekly Intake) para humanos, en 7 mg de aluminio por kg de masa corporal por semana, valor que no se ha cambiado hasta el momento.
A pesar de la abundancia ambiental de aluminio, no es un elemento esencial. La concentración natural de este elemento en los alimentos frecuentemente es baja. La ingesta promedio de aluminio, en la dieta, parece ser mayor con el uso de utensilios de este metal y la cocción en papel de aluminio. Este elemento se filtra de la lámina del papel en diferentes médios, y es significativamente mayor en los medios ácidos y acuosos en comparación con los medios alcohólicos y salinos (Ghada et al., 2012).
Además, los consumidores regulares de antiácidos muestran una gran exposición al aluminio. Una dosis diaria típica de antiácidos es 1g de aluminio o más. Otros medicamentos como las aspirinas tamponadas también contienen niveles altos de aluminio.
El aluminio es sin esfuerzo eliminado por el organismo, pero cuando se absorbe, se distribuye principalmente en los huesos, el higado, los riñones y el cerebro. La cantitad total de aluminio en un cerebro con Alzheimer es del orden de solo 1 mg, y una exposición continua durante la vida a nivles extremadamente pequeños de compuestos de aluminio, que tienden a acumularse en el cerebro, sería suficiente para producir esta cantidad (Gautier et al., 2000).
La mayor parte de la ingesta de este elemento proviene de la alimentación a través de diferentes fuentes: por el contenido natural del metal en los alimentos, su presencia en el agua, y por el uso de alimentos que contienen compuestos de aluminio como sustancias conservantes y colorantes (Loreto & Ferran, 2002)
En Ecuador no existe una norma que contemple todos los aspectos necesarios antes de comercializar utensilios, meteriales e implementos de cocina fabricados con aluminio, por lo que se fabrican y comercializan ampliamente. La preparación y almacenamiento de alimentos, en envases de este material, puede aumentar la exposición a este elemento especialmente si se trata de productos ácidos, salados o alcalinos (World Health Organization, 1997)
La migración de dicho metal a los alimentos depende de la temperatura, tiempo de cocción, el pH y la composición del alimento crudo, la presencia de ácidos orgánicos, sal y otros iones. Otra de sus grandes aplicaciones son los aditivos alimentarios. A partir del 1 de febrero del año 2014, los fabricantes de aditivos deben modificar sus condiciones de utilización y los niveles que se aplican para el aluminio, incluso en algunos casos estos aditivos han sido retirados del mercado.
Más de 150 notificaciones en el RASFF (Rapid Alert System for Food and Feed), relacionadas con migraciones de materiales en contacto con alimentos en 2014, la prohibición en 2015 del Bisfenol A en Francia y las exigencias de grandes compañias y distribuidores, son algunos datos que indican la importancia que está adquiriendo el control sobre las migraciones de materiales en contacto con alimentos (AINIA, 2018).
El 14% de la producción mundial de aluminio se destina a la fabricación de utensilios de cocina y envases para contener alimentos. La mayoría de los alimetos no interactúan facilmente con cantidades importantes del metal, pero tanto el calor suministrado durante la cocción como la adición de soluciones ácidas o salinas, aumentan considerablemente su disolución y depósito en los alimetos (Nesse et al., 2003).
El arroz es considerado el cereal más consumido en el mundo. En Ecuador el incremento de la demanda en el consumo per cápita pasó de 42 kg por persona en el año 2000 a 53,2 kg por persona en el 2013.
En este estudio se investigó si el uso de los utensilios de aluminio contribuye a la migración de este componente hacia el arroz blanco durante su cocción. Los utensilios elegidos fueron ollas de aluminio comercializadas en el mercado nacional, de fabricación local y de importación.
Según (Park & Brittin, 2000) durante los procesos de preparación de alimentos, pueden producirse alteraciones en su composición química, inocuidad y aspecto sensorial, debido al tiempo y temperatura a los que son sometidos los utensilios culinarios.
El objetivo de este estudio fue determinar la cantidad de aluminio transferido en la cocción de arroz blanco, desde diferentes muestras de ollas comercializadas en el mercado nacional ecuatoriano, mediante el método de Absorción Atómica por llama.
MATERIALES Y MÉTODOS
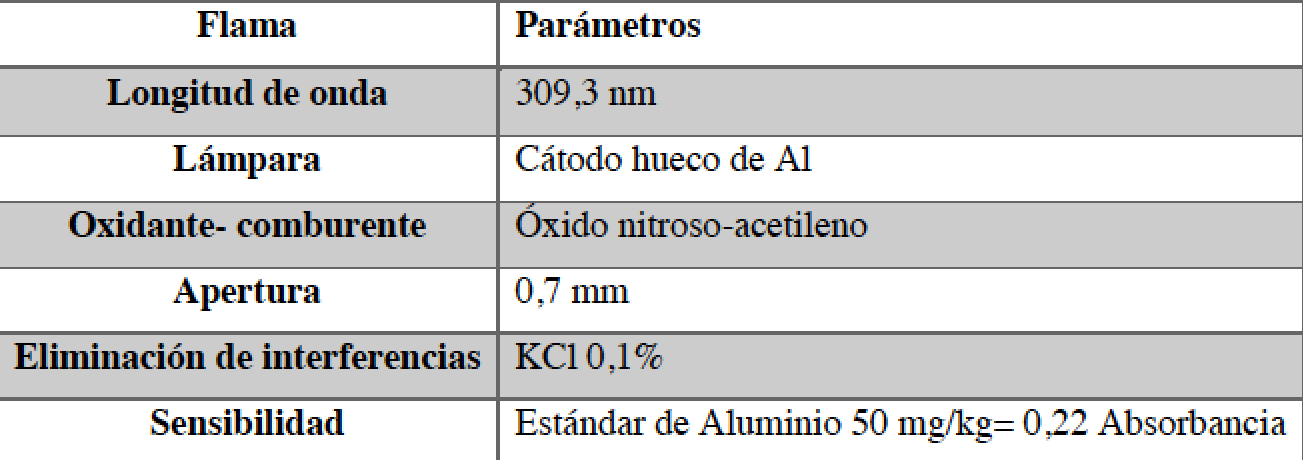
Se trabajó con seis tipos de ollas, de diferentes marcas comerciales de mayor presencia en el mercado. Las marcas adquiridas se delimitaron por una encuesta realizada de los compradores de ollas in situ en la ciudad de Quito. Se tomaron en cuenta los mercados más concurridos del cantón, estos fueron: mercados la Ofelia y Comité del Pueblo al norte de la ciudad, mercado Ipiales y locales comerciales, al centro de la ciudad, y mercado de Solanda al sur; además se visitaron sectores comerciales de La Armenia en el Valle de los Chillos y el Mercado de Lumbisí en la zona de Cumbayá. Las muestras de ollas de 1,6 litros de capacidad fueron codificadas con letras del alfabeto (A-F) y se realizó el trabajo experimental.
Preparación de las muestras
Para el estudio se adquirió arroz blanco envejecido en un supermercado de la ciudad de Quito. Se tomaron 90 gramos de arroz, a este se agregaron 180 mL de agua potable (calidad norma INEN 1 108:2011) y se coció a 92°C en cocineta eléctrica (HACEB, AR ELEC-2) por 15 minutos, agitando con cuchara de madera tres veces durante el proceso. Se realizaron seis ciclos de trabajo para cada olla, un ciclo por semana, debido a condiciones operativas y procedimentales de laboratorio.
Análisis físicos y químicos
Previo a la cocción del alimento se midió el grosor de cada olla con micrómetro analógico marca MITUTOYO (precisión ±2µm).
Para descartar aluminio como fuente indirecta, el agua potable, utilizada para la cocción, fue analizada previamente por absorción atómica (AA).
De cada unidad experimental se tomaron 50,0 gramos de arroz cocido por cada ciclo de cocción. Esta muestra se calcinó en mufla CARBOLITE (modelo RHF 1400) para obtener cenizas totales (método oficial AOAC 923.03 modificado), a continuación éstas se sometieron a un proceso de digestión ácida.
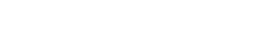
La cuantificación de aluminio se realizó mediante técnica de AA en las condiciones descritas en la tabla 2. Como blanco se utilizó arroz cocido en las mismas condiciones en una olla de acero inoxidable.
El equipo se calibró preparando diluciones sucesivas de 0,5; 1,0; 2,0; 3,0 y 4 mg/L de Al, a partir de un estándar de aluminio de 1000 mg/L (AcuSTANDARD®, Lote 216115074) por triplicado. Se construyó la curva de calibración respectiva y se verificó la linealidad, exactitud y precisión del método, así como el límite de detección (LD), porcentaje de recuperación y la repetibilidad.
Análisis estadístico
En esta etapa inicial de investigación (fase exploratoria), se aplicó un diseño por bloques de dos factores independientes, donde el factor A corresponde a las marcas de ollas y el factor B constituye ciclos de trabajo. La variable dependiente fue la concentración del aluminio transferido al arroz blanco, en seis diferentes ciclos de trabajo con tres replicas para un total 108 unidades experimentales. Con los datos obtenidos se efectuó el análisis de varianza (ANOVA), se determinó luego la presencia de diferencias estadísticas significativas entre los factores en estudio.
Los resultados se analizaron con el programa IBM SPSS Statistic, versión 20.
RESULTADOS
El análisis de las encuestas dio resultado de seis marcas de mayor consumo en el mercado nacional (Figura 1).
Espesor de ollas
Como se muestra en la Tabla 3, la marca con el código E presenta espesor promedio mínimo 0,47 ± 0,09 mm con las cinco determinaciones, mientras la marca D, tiene un espesor promedio máximo 3,35 ± 0,18 mm.
Estandarización del método
Se cumplieron los parámetros de linealidad, exactitud, precisión del método. Se estableció que el LD es de 0,4 mg Al/L, y, con cinco ciclos de extracción se obtuvo un 94,99 % de recuperación de aluminio.
Análisis físico - químicos previos
La cantidad de aluminio presente en el agua de cocción, al igual que el análisis del blanco para 5 réplicas, es inferior al LD del método. El porcentaje de cenizas del arroz blanco cocido en promedio es 0,31 % y se relaciona con el contenido de minerales.
| Código de marcas / Espesor (mm) | |||||||||||||||||
| Replicas | A B | C D | E F | ||||||||||||||
| I | 1,17 | 1,29 | 2,18 | 3,50 | 0,36 | 2,53 | |||||||||||
| II | 1,45 | 1,35 | 2,32 | 3,18 | 0,46 | 2,59 | |||||||||||
| III | 1,10 | 1,26 | 2,28 | 3,46 | 0,50 | 3,08 | |||||||||||
| IV | 1,28 | 1,31 | 2,36 | 3,31 | 0,53 | 3,05 | |||||||||||
| V | 1,20 | 1,35 | 2,21 | 3,29 | 0,51 | 2,54 | |||||||||||
| PROMEDIO | 1,24 | 1,31 | 2,27 | 3,35 | 0,47 | 2,76 | |||||||||||
| SD | 0,15 | 0,04 | 0,15 | 0,15 | 0,07 | 0,29 | |||||||||||
| LC | 1,24±0,19 | 1,31±0,05 | 2,27±0,18 | 3,35±0,18 | 0,47±0,09 | 2,76±0,36 | |||||||||||
Tratamiento y caracterización de las unidades experimentales
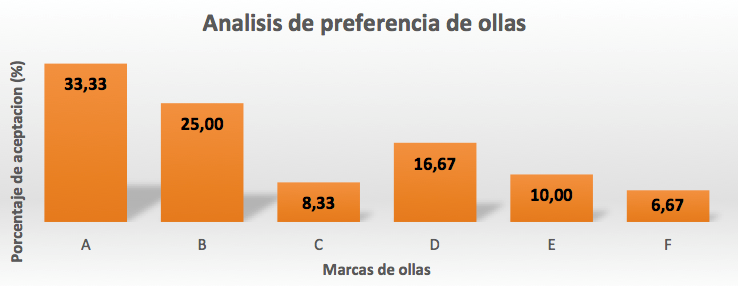
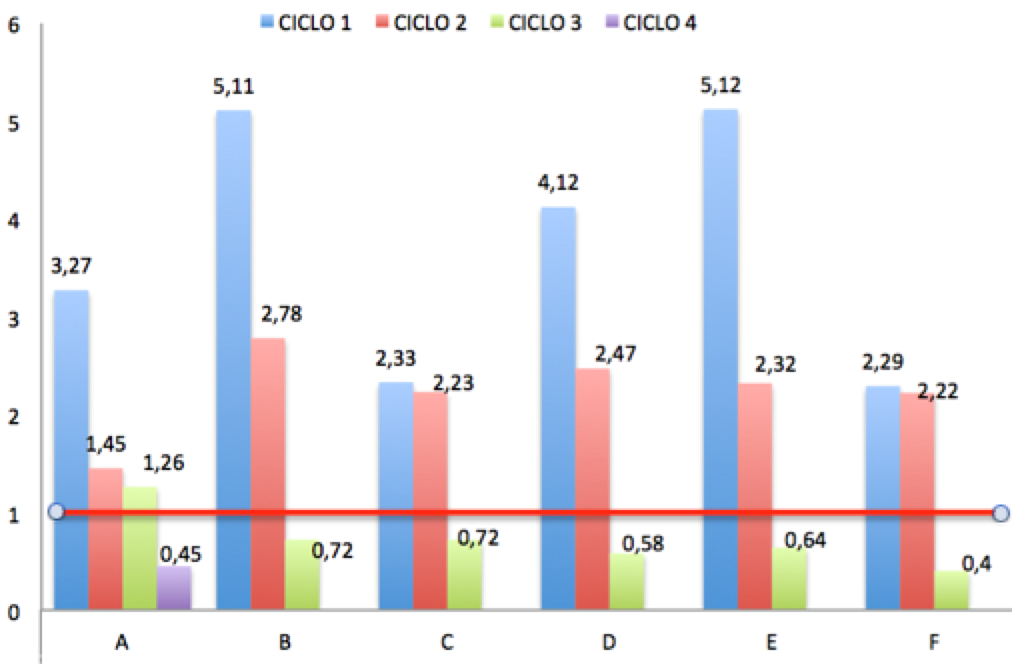
La Tabla 4 muestra los promedios de la concentración de aluminio migrado en mgAl/kg, para en cada ciclo de trabajo. Se consideró como límite de referencia el valor establecido por el Reglamento Europeo UE 14016, que es 1 mg de aluminio (Al)/kg muestra, la línea horizontal observada en la Figura 2 marca este límite.
Se evidencia que, en el primer ciclo, todas las marcas de ollas superan el límite máximo permisible, son diferentes entre sí aunque los valores más altos corresponden a las marcas B y E, con resultados similares (5,11 y 5,12 mg Al/kg respectivamente).
| MARCAS | A | B | C | D | E | F | ||||
| CICLOS | Concentración de aluminio (mg/kg muestra) | |||||||||
| 1º | 3,270 | 5,110 | 2,330 | 4,120 | 5,120 | 2,290 | ||||
| SD | 0,704 | 0,930 | 1,090 | 0,636 | 3,230 | 0,230 | ||||
| 2º | 1,450 | 2,780 | 2,230 | 2,470 | 2,320 | 2,220 | ||||
| SD | 0,390 | 0,640 | 0,035 | 0,867 | 0,950 | 0,202 | ||||
| 3º | 1,260 | 0,720 | 0,720 | 0,580 | 0,640 | 0,400 | ||||
| SD | 0,643 | 0,080 | 0,132 | 0,001 | 0,013 | 0,001 | ||||
| 4º | 0,450 | FL | FL | FL | FL | FL | ||||
| SD | 0,035 | |||||||||
| 5º | FL | FL | FL | FL | FL | FL | ||||
| 6º | FL | FL | FL | FL | FL | FL | ||||
En el segundo ciclo de trabajo la concentración de aluminio, transferido desde las ollas hacia el arroz, presenta una tendencia a la reducción. Se observa una similitud en los valores máximos, todos superan el límite referencial de 1 mg Al/kg muestra, excepto la marca A con un valor de 1,45 mg Al/kg.
Para el tercer ciclo de cocción la concentración de aluminio migrado, en todos los recipientes, es inferior al límite máximo permisible, excepto la marca A con 1,26 mg Al/kg. Por otro lado los resultados encontrados para las ollas A, en el cuarto ciclo y F en el tercero, quedan próximos al LD del equipo. A partir de estos valores las concentraciones de aluminio no son detectables, a las condiciones de trabajo, para los ciclos subsiguientes.
La Tabla 5 permite observar que los ciclos de trabajo tienen un efecto significativo al 95% de confianza a diferencia de las marcas de ollas.
| MARCAS | ||||||
| CICLOS | A | B | C | D | E | F |
| 1º | 3,27 | 5,11 | 2,33 | 4,12 | 5,12 | 2,29 |
| 2º | 1,45 | 2,78 | 2,23 | 2,47 | 2,32 | 2,22 |
| 3º | 1,26 | 0,72 | 0,72 | 0,58 | 0,64 | 0,4 |
| ANÁLISIS DE VARIANZA | ||||||
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrado medio | F | F0,05 | F0,01 |
| Ciclos | 26,7645444 | 2 | 13,3822722 | 23,1125109 | 4,10282102 | 7,55943216 |
| Macas | 3,83582778 | 5 | 0,76716556 | 1,32497098 | 3,32583453 | 5,63632619 |
| Error | 5,79005556 | 10 | 0,57900556 | |||
| Total | 36,3904278 | 17 | ||||
DISCUSIÓN
El resultado obtenido en cenizas muestra es similar a otros resultados reportados (Aldaco, 2010), esto indica que el aporte nutricional de minerales en el arroz blanco es muy escaso.
En relación a migración del aluminio en los seis ciclos de cocción, se observa que hasta el tercer ciclo de trabajo la cantidad de aluminio es detectable, y en la mayoría de los casos se encuentra por debajo del límite máximo establecido por el Reglamento Europeo UE1416:2016 (1mg/kg de alimento).
El análisis de varianza (ANOVA), permite determinar que no existe diferencia significativa entre marcas de ollas, por otro lado para ciclos de cocción secuenciales, existe una diferencia altamente significativa en la cantidad de aluminio migrada desde los recipientes hacia el alimento.
El descenso en la transferencia de aluminio desde las ollas hacia el arroz, en relación con el aumento de ciclos de uso, demuestra que la marca A mantiene la mayor migración del aluminio.
La alta dispersión en los grosores de las ollas contribuye a una transferencia de calor muy heterogénea. La alta variabilidad en los resultados obtenidos, en la concentración de aluminio migrado al arroz blanco cocido, demuestra la posible influencia de la calidad del material utilizado en las ollas del estudio, además del proceso de fabricación y tipo de acabado final. Ningún material de las ollas en estudio es de aluminio anodizado, el cual tiene una capa protectora que evita que el metal pase al alimento. (Vergara et al., 2011) Estos resultados confirman lo expuesto por Suay que menciona que “la preparación y almacenaje de alimentos en envases de aluminio puede aumentar su contenido especialmente si se trata de alimentos ácidos, salados o alcalinos” (2002).
CONCLUSIONES
El estudio permitió verificar que ocurre con la migración de aluminio en ollas de mismo material durante la preparación del arroz blanco, alimento de pH neutro, en varios ciclos de cocción.
El análisis fisicoquímico del arroz blanco (Oryza sativa L.) cocido indica su escaso aporte nutricional. El descenso en la migración del metal, al aumentar los ciclos de uso de las ollas nuevas, indica que la cantidad de aluminio transferido durante la cocción puede estar en función del grosor de la olla y de la calidad del material utilizado en su fabricación.
De forma general, a partir de un tercer ciclo de cocción la cantidad de aluminio encontrado en arroz blanco se encuentra por debajo del límite máximo establecido por el Reglamento Europeo UE1416:2016 (1mg/kg de alimento).
Referencias
AINIA, C. t. (2018). www.ainia.es. Recuperado de http://informacion.ainia.es/web/tecnoalimetalia/legislacion-y-ayudas/articulos/rT64/content/actualizacion-de-la-legislacion-ue-sobre-meteriales-y-objetos-plasticos-en-contacto-con-alimentos
Aldaco F. (2010). Evaluación fisico química de dos variedades de arroz, blanco y morado para determinar cualidades nutricionales. Buenavista, Saltillo, Coahuila, Mexico.
Flaten, T. P. (2001). Aluminium as risk factor in Alzheimer's disease, with emphasis on drinking water. Brain. Res. Bull., 55(2), 187-196.
Gautier et al., (2000). Aluminium forms in drinking water and risk of Alzheimer's disease. Enviro. Res. 84(3), 234-246.
Loreto & Ferran (2002). Revision de los estudios sobre exposición al aluminio y enfermedad de Alzheimer. Rev Esp Salud Publica, 78, 645-658.
López et al., (2000). Aluminium content in foods and beverages consumed in the Spanish diet. Journal of Food Science , 65(2), 206-2010.
Nesse et al., (2003). Alumino:¿culpable o inocente? Quimica viva , 2(1), 9-13.
Park J. & Brittin H. (2000). Iron content, sensory evaluation, and consumer acceptance of food cooked in iron utensils. Journal of Food Quality, 23, 205-215.
Schifman & Luevano (2018). Aluminium Toxicity: evaluation of 16-year trend among 14919 Patients and 45480 Results, Archives of pathology & laboratory medicine, 142(6), 742.
Suay L., Ballester F. (2002). Revisión de los estudios sobre exposición al aluminio y enfermedad de Alzheimer. Salud Publica Española, 76, 645-658.
Vergara L. et al., (2011). Modelo predictivo de la rugorosidad y porosidad en aluminio Al3003-B14 y Al16063-T6 anodizado. Revista Ciencia y Ingenieria, 32, 105-112.
World Health Organization. (1997). International programme on chemical safety. Envinmental criteria 194: Alunium. Geneve: United Nations Environment Program.
Notas