INTRODUCCIÓN
La nanotecnología cada día se convierte en uno de los campos más investigados, debido al gran número de aplicaciones que proporciona en el área de la química, la biología, la medicina, la electrónica, entre otros. Las nanopartículas, con un tamaño menor a 100 nm, pueden prepararse a través de diferentes técnicas, por medio de métodos químicos, electroquímicos, de radiación, fotoquímicos y biológicos. El método biológico realizado a través de la “síntesis verde”, ha ganado notoriedad, ya que evita el uso de compuestos tóxicos y peligrosos. De igual manera disminuye el riesgo biológico que conlleva la experimentación con cultivos microbiológicos que requieren procedimientos complejos (Mittal et al., 2013; Roy & Das, 2015).
El estudio de la síntesis verde durante los últimos 30 años ha permitido descubrir el potencial de los extractos de plantas para reducir iones metálicos, lo que resulta en la formación de nanopartículas de tamaños y morfologías estables. Se sugiere que los extractos de plantas cumplen con dos funciones: reducir y estabilizar a las nanopartículas. Además, de ser un método simple, económico y amigable con el medio ambiente (Mittal et al., 2013).
Las nanopartículas que contienen metales tales como la plata (AgNPs), son ampliamente utilizadas por su eficiente actividad óptica y antimicrobiana. Su efecto a nivel nanométrico está ligado a la alta relación entre su volumen y el área de superficie. Las nanopartículas de plata pueden ser fácilmente preparadas con extractos de plantas (Roy & Das, 2015).
Uno de los principales campos de aplicación de las AgNPs preparadas con extractos de plantas, es la biomedicina, pues por su biocompatibilidad y baja toxicidad, pueden ser empleadas en el diagnóstico y terapias contra el cáncer. Así lo han reportado investigaciones que emplearon AgNPs con extractos, y como resultado, inhibieron el crecimiento de células cancerígenas de colon (Prabhu et al., 2013), y cuello uterino (HeLa) (Singh et al., 2018 & Tripathi et al. 2019)
Allium sativum, comúnmente conocida como ajo, forma parte de la familia Amaryllidaceae. Es una especie herbácea perenne, cuyo tallo puede llegar a medir 0,9 m. Está formada por un bulbo y hojas presentes al final del tallo. El ajo tiene un alto contenido de compuestos con azufre, que contribuyen a sus propiedades bioactivas. El bulbo de ajo, usado como medicina y condimento desde tiempos remotos, ha sido estudiado extensamente por sus propiedades laxante, diurética, antioxidante y anticancerígena; y actividades antimicrobiana, antifúngica, antiviral y antiprotozoaria. Además, su aplicación para el tratamiento de enfermedades causadas por agentes patógenos es muy amplia (Harris et al., 2001; Meriga et al, 2012).
Uno de los primeros estudios empleando bulbos de ajo, logró producir AgNPs altamente estables y con un gran potencial antibacteriano frente a microorganismos Gram positivos y Gram negativos (Rastogi & Arunachalam, 2011). Estudios similares demostraron la biocompatibilidad del extracto de ajo con nanopartículas de oro (muy parecidas químicamente a la plata), empleadas como agentes de liberación de fármacos (Rastogi & Arunachalam, 2013). Por otro lado, al utilizar el extracto de ajo con otro tipo de nanopartículas como óxido de zinc, se demostró su capacidad bactericida frente a las cepas de Staphylococcus aureus, Bacillus subtilis, Listeria monocytogenes, Escherichia coli, Salmonella typhimurium y Pseudomonas aeruginosa (Stan et al., 2016).
Las propiedades ligadas a la
composición química de las hojas de ajo son de gran interés dentro del campo de
la química aplicada, sin embargo, no se han encontrado publicaciones que describan
la síntesis de AgNPs con su extracto acuoso. Los únicos reportes encontrados
hasta la fecha están relacionados al campo de la biología y biotecnología. Se
ha estudiado la actividad biológica de flavonoides y otros compuestos en
ensayos in vivo (Abdo & Al-Kafawi, 1969) e
in vitro (Broadhurst et al., 2000; Kim et al.,
2005). Otros
estudios, reportan las interacciones de la aglutinina presente en sus hojas,
con otros grupos funcionales aislados de microorganismos para usarla como una
proteína antifúngica (Banerjee et al., 2004; Ghosh et al., 2013).
Por otro lado, otros grupos experimentaron con las lectinas de las hojas,
aislando, caracterizando y clonándolas molecularmente (Smeets et al., 1997) para
crear una proteína insecticida contra insectos homópteros presentes en plantas
de tabaco transgénico (Dutta et al., 2005).
Con estos antecedentes, en este estudio se empleó el extracto acuoso de hojas de ajo (A. sativum) para producir nanopartículas de plata, empleando calentamiento por placa y microondas.
MATERIALES
Y MÉTODOS
Muestreo
Hojas
frescas de A. sativum se recolectaron
en el sector de Quiroga, Ibarra-Ecuador (Figura 1), coordenadas geográficas: 0°17`11.3"N, 78°17'14.5"O
a 2480 m.s.n.m.
 Figura
1.
Figura
1. Sitio de muestreo de las hojas de A.
sativum
Autor
Figura
1.
Figura
1. Sitio de muestreo de las hojas de A.
sativum
Autor
Las muestras se desinfectaron con etanol al 60 %. Luego pasaron por
un período de cuarentena a una temperatura de -2 a -4 °C en un refrigerador
marca Ecasa®. Las hojas se secaron a una temperatura de 40 °C por 10 horas en
un deshidratador marca Termokool®, de acuerdo a lo sugerido por Morejón et al. (2018). Finalmente, las hojas se trituraron en un mortero
de cuarzo.
Preparación
del extracto
Para el extracto acuoso de las hojas
de ajo, se empleó 1 g de muestra, 20 mL de agua destilada y calentamiento con
agitación constante en una placa de calentamiento marca Velp ® a 50 °C durante 1
h.
Síntesis
de AgNPs
Para la síntesis de nanopartículas de
plata se siguió el método sugerido por Kesharwani et al. (2009),
con ligeras modificaciones. Se emplearon 20 mL de AgNO3 marca
Scharlau® 1 mM y 1 mL del
extracto acuoso de hojas de ajo. Se ajustó el pH a 8 con NaOH marca Merck® al 1
%, y se mantuvo en agitación constante en la placa de calentamiento a 300
r.p.m. durante 1 h a 50 °C de temperatura. En el segundo método, se emplearon 20 mL de AgNO3
1 mM, 1 mL del extracto acuoso, a pH 8, tiempo 1 min, y potencia 800 W usando
un microondas Indurama® modelo MWI 28BL.
Caracterización
de AgNPs
Para caracterizar a las
nanopartículas de plata obtenidas, se empleó un espectrofotómetro UV-Visible de doble haz Cary 60 Agilent
Technologies® y celdas de cuarzo. Para el estudio de
microscopía electrónica de transmisión (TEM) se usó un equipo de marca FEI®,
modelo Tecnai Spirit G2. El radio hidrodinámico de las nanopartículas fue
medido con un medidor de dispersión dinámica de luz (DLS) usando un Nanoparticle Size Analyzer LB-550 marca Horiba®.
La presencia de plata en las muestras se analizó con un difractómetro de rayos
X (PANalytical) en configuración de Bragg-Brentano a 40 kV y 45 mA con un
monocromador de rayos X de Cu K-alpha (λ= 1.541 Å).
Tratamiento
de datos
Para analizar si existe diferencia
significativa en el tamaño de nanopartícula obtenido con los tratamientos de
calentamiento por placa y microondas, se emplearon pruebas t y F mediante
Microsoft Excel. Previo al análisis de resultados, se eliminaron los valores
atípicos mediante la evaluación de los rangos intercuartílicos (IQR score).
RESULTADOS
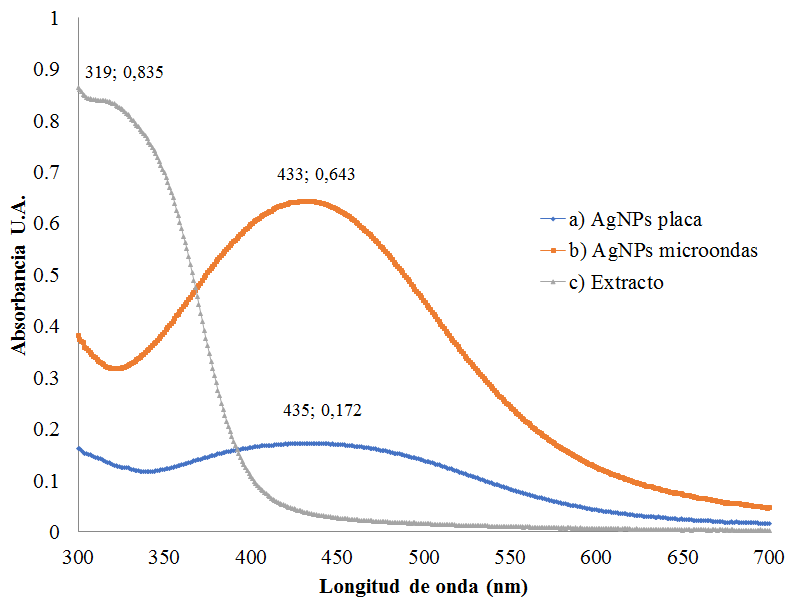
Los espectros UV-Vis de las AgNps
usando placa de calentamiento (a) y microondas (b), en comparación con el
extracto (c), se aprecian en la Figura 2. Las longitudes de onda máxima se
obtuvieron a 435 nm para el caso del calentamiento con placa, 433 nm para el
microondas y 319 nm para el extracto.
 Figura
2.
Espectros UV-Vis de AgNps usando extracto acuoso de hojas de ajo empleando
(a) placa de calentamiento, (b) microondas de A. sativum (c) extracto de A.
sativum
Autor
Figura
2.
Espectros UV-Vis de AgNps usando extracto acuoso de hojas de ajo empleando
(a) placa de calentamiento, (b) microondas de A. sativum (c) extracto de A.
sativum
Autor
En la Figura 3 se muestran las micrografías TEM de las AgNPs, empleando las dos técnicas de calentamiento por placa (a) y microondas (b). Los histogramas de tamaño de nanopartícula se muestran en la Figura 4. El tamaño promedio fue de 15,4 ±7,9 (4a) y 9,9 ±10,5 nm (4b) respectivamente.
El tamaño del recubrimiento orgánico medido por el DLS, fue de 40,5±8,3 y 35,1±9,7 nm usando el extracto acuoso de hojas de ajo por calentamiento en placa y microondas, respectivamente.
 Figura
3.
Micrografías TEM de AgNps usando extracto acuoso de hojas de ajo empleando
(a) placa de calentamiento y (b) microondas
Figura
3.
Micrografías TEM de AgNps usando extracto acuoso de hojas de ajo empleando
(a) placa de calentamiento y (b) microondas
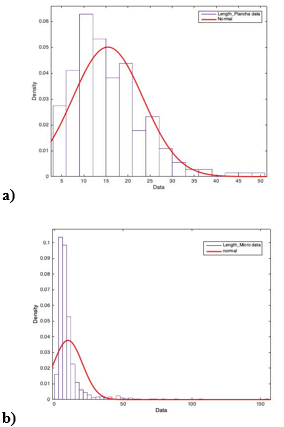 Figura 4.
Histogramas de frecuencia de tamaño de AgNps usando extracto acuoso de hojas
de ajo empleando (a) placa de calentamiento y (b) microondas
Figura 4.
Histogramas de frecuencia de tamaño de AgNps usando extracto acuoso de hojas
de ajo empleando (a) placa de calentamiento y (b) microondas
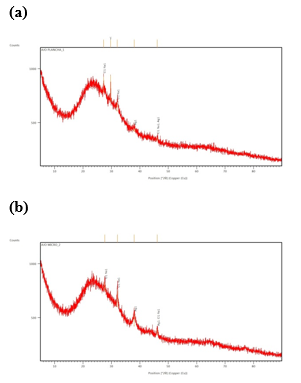
En cuanto a la composición cristalina
analizada por XRD (Figura 5), las dos muestras presentaron en el difractograma
Ag en el ángulo 38,0º y NaCl en placa de
calentamiento (a): 27,8º 28,4º 32,3º 35,9º; y microondas (b): 27,7º 27,84º 32,3º
37,9º.
 Figura
5.
Difractogramas XRD de AgNps (a) placa y (b) microondas
Figura
5.
Difractogramas XRD de AgNps (a) placa y (b) microondas
Con los datos de las mediciones del
diámetro de AgNPs, se realizaron pruebas de rango intercuartílico, que se
muestran en la Figura 6, para cada tratamiento, con la finalidad de evaluar la
presencia de valores atípicos. En el tratamiento con microondas se obtuvo un 7,9
% de las mediciones identificadas como outliers,
frente al 2,5 % del otro tratamiento. Como se puede observar, se visualizan
estos valores como los puntos fuera de la caja. Cabe señalar que en ambos casos
se realizaron más de 100 mediciones.
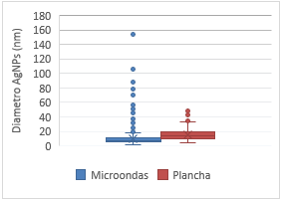 Figura
6.
Diagramas de caja y bigote para la distribución del tamaño de AgNPs
obtenidas con extracto de hojas de ajo y con cada tratamiento de calentamiento
Figura
6.
Diagramas de caja y bigote para la distribución del tamaño de AgNPs
obtenidas con extracto de hojas de ajo y con cada tratamiento de calentamiento
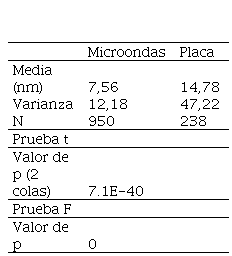
Una vez identificados y eliminados
los valores atípicos, se comparó si existe diferencia significativa en el
tamaño de nanopartícula (prueba t) y su variabilidad (prueba F) con relación al
tipo de calentamiento utilizado en el proceso de síntesis. Estos resultados se
indican en la Tabla 1.
Tabla 1.
Análisis estadístico de resultados del tamaño de AgNPs obtenidas con
extracto de hojas de ajo y con cada tratamiento de calentamiento
|
Microondas
|
Placa
|
|
Media (nm)
|
7,56
|
14,78
|
|
Varianza
|
12,18
|
47,22
|
|
N
|
950
|
238
|
|
Prueba t
|
|
Valor de p (2 colas)
|
7.1E-40
|
|
Prueba F
|
|
Valor de p
|
0
|
DISCUSIÓN
Las AgNPs obtenidas mostraron un máximo de absorción a 435 nm usando placa de calentamiento y 433 nm con microondas, a diferencia del extracto, que muestra su absorción a los 319 nm. De acuerdo a la estimación del tamaño de nanopartícula por Espectrofometría UV-Vis propuesta por Pradeep (2012), el plasmón de superficie de las AgNps se muestra a los 400 nm, sugiriendo un valor aproximado con recubriendo orgánico de 30 a 50 nm. El tamaño real medido por TEM, indicó que el menor valor fue el obtenido por medio de microondas (9,9 ±10,5 nm). La diferencia con el valor estimado por espectrofotometría UV-Vis, se debe a que la micrografía TEM muestra únicamente el núcleo metálico de Ag y no el recubrimiento orgánico. La micrografía de la Figura 2b usando microondas, además, muestra un gran número de nanopartículas esféricas, a diferencia de la muestra obtenida por placa de calentamiento.
De acuerdo a la composición química de las plantas, existen diferentes grupos funcionales como los azúcares reductores, compuestos fenólicos o ácidos orgánicos, que facilitan la reducción de iones metálicos (Ahmed et al., 2016; Mittal et al., 2013). El ajo contiene compuestos orgánicos que actúan como agentes reductores y estabilizantes (Bender-Bojalil & Bárcenas-Pozos, 2013). Al comparar el tamaño de AgNps usando el extracto de hojas con el de bulbo de ajo, los resultados de este estudio muestran tamaños mucho menores que los reportados en la bibliografía (Cardeño, 2014).
Las medidas realizadas por medio de DLS indican el espesor de la capa de recubrimiento del material orgánico para los dos tipos de calentamiento (Ramesh et al., 2016). El menor tamaño de nanopartícula recubierta se dio usando microondas. Los valores de DLS obtenidos concuerdan con el tamaño de nanopartícula estimado por espectrofotometría UV-Vis (30 a 50 nm).
El análisis cristalográfico confirmó la presencia Ag en el ángulo 38,0º, correspondiente al plano (111) de una estructura cúbica (Vizuete et al., 2016). La mayor cantidad de Ag se encontró en las muestras preparadas por microondas, lo cual significa que este proceso es más eficiente en la generación de nanopartículas.
De acuerdo con el análisis estadístico, existe diferencia significativa entre el tamaño de nanopartícula obtenido con placa de calentamiento y microondas. Los resultados de la Tabla 1 indican que en ambos casos se rechaza la hipótesis nula por haberse obtenido un valor p menor a 0,05, por lo tanto, el tratamiento de calentamiento tiene una influencia significativa en el resultado. Con la síntesis por microondas se obtuvieron AgNPs de menor tamaño (9,9 nm) y con una distribución más homogénea, ya que, al eliminar los valores atípicos, el 40 % de las mediciones se encuentran en el rango ±25 % de la media, esto comparado a las nanopartículas obtenidas con placa de calentamiento, cuyo tamaño promedio fue de 15,4 nm y donde sólo el 8 % de los valores se encuentran en el rango ±25 % de la media, lo que denota una mayor dispersión de los diámetros obtenidos.
Se sugiere la síntesis vía microondas, debido a su rapidez y cantidad de nanopartículas obtenidas (Ahmed et al., 2016; Mittal et al., 2013; Von White et al., 2012). Estudios similares, avalan el uso de microondas en la síntesis de nanopartículas de plata empleando extractos de plantas (Kahrilas et al., 2014).
CONCLUSIÓN
El extracto acuoso de las hojas de ajo A. sativum es un agente reductor adecuado para la formación de AgNps, por su potencial aplicación en el campo biomédico. Los tamaños promedio obtenidos fueron de 15,4 ±7,9 y 9,9 ±10,5 nm usando dos técnicas de calentamiento (placa y microondas) respectivamente. Los tamaños hidrodinámicos fueron de 40,5±8,3 y 35,1±9,7 nm. El análisis cristalográfico confirmó la presencia de plata en las muestras analizadas. El tratamiento estadístico del tamaño de nanopartículas obtenidas, indica que existe una diferencia significativa de acuerdo al tipo de calentamiento, por lo que se sugiere el uso del microondas para la síntesis de AgNPs.
Agradecimientos
Este estudio fue realizado dentro del
proyecto PUCE “Síntesis, caracterización y modelamiento computacional de
nanopartículas de plata usando extractos de plantas nativas de la provincia de
Imbabura”, Código
O13083, QINV0080-IINV529020200.
Referencias
Abdo, M. S., & Al-Kafawi, A. A. (1969). Biological Activities of Allium Sativum. The Japanese Journal of Pharmacology, 19(1), 1–4.
Ahmed, S., Ahmad, M., Swami, B. L., & Ikram, S. (2016). A review on plants extract mediated synthesis of silver nanoparticles for antimicrobial applications: A green expertise. Journal of Advanced Research, 7(1), 17–28.
Bender-Bojalil, D., & Bárcenas-Pozos, M. E. (2013). El ajo y sus aplicaciones en la conservación de alimentos. Temas Selectos de Ingeniería de Alimentos, 7(1), 25–36.
Broadhurst, C. L., Polansky, M. M., & Anderson, R. A. (2000). Insulin-like Biological Activity of Culinary and Medicinal Plant Aqueous Extracts in Vitro. Journal of Agricultural and Food Chemistry, 48(3), 849–852.
Cardeño, L., & Londoño, M. E. (2014). Síntesis verde de nanopartículas de plata mediante el uso del ajo (Allium sativum). Revista Soluciones de Postgrado EIA, 6(12), 129–140.
Dutta, I., Saha, P., Majumder, P., Sarkar, A., Chakraborti, D., Banerjee, S., & Das, S. (2005). The efficacy of a novel insecticidal protein, Allium sativum leaf lectin (ASAL), against homopteran insects monitored in transgenic tobacco. Plant Biotechnology Journal, 3(6), 601–611.
Ghosh, P., Roy, A., Chakraborty, J., & Das, S. (2013). Biological Safety Assessment of Mutant Variant of Allium sativum Leaf Agglutinin (mASAL), a Novel Antifungal Protein for Future Transgenic Application. Journal of Agricultural and Food Chemistry, 61(48), 11858–11864.
Harris, J. C., Cottrell, S. L., Plummer, S., & Lloyd, D. (2001). Antimicrobial properties of Allium sativum (garlic). Applied Microbiology and Biotechnology, 57(3), 282–286.
Kahrilas, G. A., Wally, L. M., Fredrick, S. J., Hiskey, M., Prieto, A. L., & Owens, J. E. (2014). Microwave-Assisted Green Synthesis of Silver Nanoparticles Using Orange Peel Extract. ACS Sustainable Chemistry & Engineering, 2(3), 367–376.
Kesharwani, J., Yoon, K. Y., Hwang, J., & Rai, M. (2009). Phytofabrication of Silver Nanoparticles by Leaf Extract of Datura metel: Hypothetical Mechanism Involved in Synthesis. Journal of Bionanoscience, 3(1), 39–44.
Kim, M.-Y., Kim, Y.-C., & Chung, S.-K. (2005). Identification and in vitro biological activities of flavonols in garlic leaf and shoot: inhibition of soybean lipoxygenase and hyaluronidase activities and scavenging of free radicals. Journal of the Science of Food and Agriculture, 85(4), 633–640.
Meriga, B., Mopuri, R., & MuraliKrishna, T. (2012). Insecticidal, antimicrobial and antioxidant activities of bulb extracts of Allium sativum. Asian Pacific Journal of Tropical Medicine, 5(5), 391–395.
Mittal, A. K., Chisti, Y., & Banerjee, U. C. (2013). Synthesis of metallic nanoparticles using plant extracts. Biotechnology Advances, 31(2), 346–356.
Morejón, B., Pilaquinga, F., Domenech, F., Ganchala, D., Debut, A., & Neira, M. (2018). Larvicidal Activity of Silver Nanoparticles Synthesized Using Extracts of Ambrosia arborescens (Asteraceae) to Control Aedes aegypti L. (Diptera: Culicidae). Journal of Nanotechnology, 2018, 1–8.
Prabhu, D., Arulvasu, C., Babu, G., Manikandan, R., & Srinivasan, P. (2013). Biologically synthesized green silver nanoparticles from leaf extract of Vitex negundo L. induce growth-inhibitory effect on human colon cancer cell line HCT15. Process Biochemistry, 48(2), 317–324.
Pradeep, T. (2012). A Textbook of Nanoscience and Nanotechnology (1 Ed.). Nueva Deli: McGraw Hill.
Ramesh, S., Grijalva, M., Debut, A., de la Torre, B. G., Albericio, F., & Cumbal, L. H. (2016). Peptides conjugated to silver nanoparticles in biomedicine – a “value-added” phenomenon. Biomaterials Science, 4(12), 1713–1725.
Rastogi, L., & Arunachalam, J. (2011). Sunlight based irradiation strategy for rapid green synthesis of highly stable silver nanoparticles using aqueous garlic (Allium sativum) extract and their antibacterial potential. Materials Chemistry and Physics, 129(1–2), 558–563.
Rastogi, L., & Arunachalam, J. (2013). Green synthesis route for the size controlled synthesis of biocompatible gold nanoparticles using aqueous extract of garlic (Allium sativum). Advanced Materials Letters, 4(7), 548–555.
Roy, S., & Das, T. K. (2015). Plant Mediated Green Synthesis of Silver Nanoparticles-A Review. International Journal of Plant Biology & Research, 3(03), 1044–1055.
Singh, H., Du, J., Singh, P., & Yi, T. H. (2018). Ecofriendly synthesis of silver and gold nanoparticles by Euphrasia officinalis leaf extract and its biomedical applications. Artificial Cells, Nanomedicine, and Biotechnology, 46(6), 1163–1170.
Smeets, K., Van Damme, E. J. M., Verhaert, P., Barre, A., Rougé, P., Van Leuven, F., & Peumans, W. J. (1997). Isolation, characterization and molecular cloning of the mannose-binding lectins from leaves and roots of garlic (Allium sativum L.). Plant Molecular Biology, 33(2), 223–234.
Stan, M., Popa, A., Toloman, D., Silipas, T.-D., & Vodnar, D. C. (2016). Antibacterial and Antioxidant Activities of ZnO Nanoparticles Synthesized Using Extracts of Allium sativum, Rosmarinus officinalis and Ocimum basilicum. Acta Metallurgica Sinica (English Letters), 29(3), 228–236.
Tripathi, D., Modi, A., Narayan, G., & Rai, S. P. (2019). Green and cost effective synthesis of silver nanoparticles from endangered medicinal plant Withania coagulans and their potential biomedical properties. Materials Science and Engineering: C, 100, 152–164.
Vizuete, K. S., Kumar, B., Vaca, A. V., Debut, A., & Cumbal, L. (2016). Mortiño (Vaccinium floribundum Kunth) berry assisted green synthesis and photocatalytic performance of Silver–Graphene nanocomposite. Journal of Photochemistry and Photobiology A: Chemistry, 329, 273–279.
Von White, G., Kerscher, P., Brown, R. M., Morella, J. D., McAllister, W., Dean, D., & Kitchens, C. L. (2012). Green synthesis of robust, biocompatible silver nanoparticles using garlic extract. Journal of Nanomaterials, 2012, 55.
Notas
[1] Pontificia Universidad Católica del Ecuador, Facultad de Ciencias Exactas y Naturales, Escuela de Ciencias Químicas, Quito, Ecuador (*correspondencia: mfpilaquingaf@puce.edu.ec; katherine.pazmino@yahoo.es; alex-robalino@hotmail.com; enjara@puce.edu.ec; lmmeneses@puce.edu.ec ).
2 Pontificia Universidad Católica del Ecuador-Sede Ibarra, Herbario, Ibarra, Ecuador (mflopez2@pucesi.edu.ec).
3 Universidad de las Fuerzas Armadas ESPE, CENCINAT, Sangolquí, Ecuador (ksvizuete@espe.edu.ec; apdebut@espe.edu.ec ).
Notas de autor
mfpilaquingaf@puce.edu.ec











