Resumen: Las reacciones de transferencia de electrones de biomoléculas son un foco importante de extensas investigaciones en Químicas, Físicas y Bioquímicas. La electroquímica proporciona herramientas poderosas para estudiar procesos de transferencia de electrones en sistemas bioquímicos, siendo las enzimas moléculas de particular interés. Entre los nanomateriales para la inmovilización de enzimas sobre superficies electródicas, las nanopartículas de oro son una buena alternativa por sus propiedades: biocompatibilidad, alta propiedades electroactivas, fuerte capacidad de adsorción, relación superficie-volumen y alta actividad catalítica. El peróxido de hidrógeno (H2O2), sustrato de la enzima peroxidasa de rábano o "Horseradish Peroxidase", desempeña papeles críticos en sistemas industriales, biológicos, farmacéuticos y muchos otros campos. El nivel de concentración de H2O2 es un parámetro biológico significativo en el estudio de la enfermedad como el Alzheimer, infarto de miocardio, enfermedad de Parkinson, Cáncer, etc. Por lo anterior, es de gran importancia desarrollar métodos eficientes para la detección sensible y selectiva de H2O2 bajo condiciones fisiológicas. En el presente manuscrito, se revisa el uso de nanopartículas de oro en electrodos modificados para la inmovilización de enzimas (biosensores) para determinación de H2O2. Los resultados más relevantes indican que las nanopartículas de oro favorecen la transferencia directa de electrones entre la proteína redox y el electrodo. Las nanopartículas de oro, proporcionan un entorno natural para la inmovilización biomolecular que permite su mayor estabilidad y tiempo de vida sobre el electrodo.
Palabras clave: Biosensores electroquímicos enzimáticos, Nanopartículas de oro, Peroxidasa de rábano.
Abstract: The electron transfer reactions of biomolecules are an important focus of extensive research in Chemistry, Physics, and Biochemistry. Electrochemistry provides powerful tools for studying electron transfer processes in biochemical systems, where the enzymes are molecules of particular interest. Among the nanomaterials for enzyme immobilization on electrode surfaces, gold nanoparticles are a good alternative for their properties: biocompatibility, high electroactive properties, strong adsorption capacity, surface-volume ratio and high catalytic activity. Hydrogen peroxide (H2O2), a substrate for the enzyme "Horseradish Peroxidase", plays critical roles in industrial, biological, pharmaceutical and many other fields. The level of H2O2 concentration is a significant biological parameter in the study of diseases such as Alzheimer's, myocardial infarction, Parkinson's disease, Cancer, etc. Therefore, it is of great importance to develop efficient methods for the sensitive and selective detection of H2O2 under physiological conditions. In the present manuscript, the use of gold nanoparticles in enzymatic modified electrodes (biosensors) for the determination of H2O2 is revised. The most relevant results indicate that gold nanoparticles favor the direct transfer of electrons between the redox protein and the electrode. Gold nanoparticles provide a natural environment for bimolecular immobilization that allows for greater stability and lifetime on the electrode.
Keywords: Enzymatic electrochemical biosensors, Gold nanoparticles, Horseradish peroxidase.
Artículos científicos
ELECTRODOS MODIFICADOS CON NANOPARTÍCULAS DE ORO Y SU APLICACIÓN EN BIOSENSORES ELECTROQUÍMICOS QUE UTILIZAN PEROXIDASA DE RÁBANO COMO SISTEMADE BIORECONOCIMIENTO BIOLÓGICO: DETECCIÓN DE PERÓXIDO DE HIDRÓGENO
MODIFIED ELECTRODES WITH GOLD NANOPARTICLES AND THEIR APPLICATION IN ELECTROCHEMICAL BIOSENSORS USING HORSERADISH PEROXIDASE AS A BIOLOGICAL BIORECONOSIMENTO SYSTEM: DETECTION OF HYDROGEN PEROXIDE
Recepción: 16 Julio 2020
Aprobación: 30 Octubre 2020
Las reacciones de transferencia de electrones de biomoléculas son un foco importante de extensas investigaciones en Químicas, Físicas y Bioquímicas. La electroquímica proporciona herramientas poderosas para estudiar procesos de transferencia de electrones en sistemas bioquímicos, siendo las enzimas moléculas de particular interés. Entre los nanomateriales para la inmovilización de enzimas sobre superficies electródicas, las nanopartículas de oro son una buena alternativa por sus propiedades: biocompatibilidad, alta propiedades electroactivas, fuerte capacidad de adsorción, relación superficie-volumen y alta actividad catalítica. El peróxido de hidrógeno (H2O2), sustrato de la enzima peroxidasa de rábano o "Horseradish Peroxidase", desempeña papeles críticos en sistemas industriales, biológicos, farmacéuticos y muchos otros campos. El nivel de concentración de H2O2 es un parámetro biológico significativo en el estudio de la enfermedad como el Alzheimer, infarto de miocardio, enfermedad de Parkinson, Cáncer, etc. Por lo anterior, es de gran importancia desarrollar métodos eficientes para la detección sensible y selectiva de H2O2 bajo condiciones fisiológicas. En el presente manuscrito, se revisa el uso de nanopartículas de oro en electrodos modificados para la inmovilización de enzimas (biosensores) para determinación de H2O2. Los resultados más relevantes indican que las nanopartículas de oro favorecen la transferencia directa de electrones entre la proteína redox y el electrodo. Las nanopartículas de oro, proporcionan un entorno natural para la inmovilización biomolecular que permite su mayor estabilidad y tiempo de vida sobre el electrodo.
The electron transfer reactions of biomolecules are an important focus of extensive research in Chemistry, Physics, and Biochemistry. Electrochemistry provides powerful tools for studying electron transfer processes in biochemical systems, where the enzymes are molecules of particular interest. Among the nanomaterials for enzyme immobilization on electrode surfaces, gold nanoparticles are a good alternative for their properties: biocompatibility, high electroactive properties, strong adsorption capacity, surface-volume ratio and high catalytic activity. Hydrogen peroxide (H2O2), a substrate for the enzyme "Horseradish Peroxidase", plays critical roles in industrial, biological, pharmaceutical and many other fields. The level of H2O2 concentration is a significant biological parameter in the study of diseases such as Alzheimer's, myocardial infarction, Parkinson's disease, Cancer, etc. Therefore, it is of great importance to develop efficient methods for the sensitive and selective detection of H2O2 under physiological conditions. In the present manuscript, the use of gold nanoparticles in enzymatic modified electrodes (biosensors) for the determination of H2O2 is revised. The most relevant results indicate that gold nanoparticles favor the direct transfer of electrons between the redox protein and the electrode. Gold nanoparticles provide a natural environment for bimolecular immobilization that allows for greater stability and lifetime on the electrode.
En el desarrollo de técnicas analíticas a lo largo de las últimas décadas, se ha destacado la creación de métodos y dispositivos capaces de realizar determinaciones cada vez más exactas y precisas, de una gran variedad de analitos (Siddiqui et al., 2017). Las diferencias intrínsecas entre las especies químicas a cuantificar, han derivado en un conjunto bastante heterogéneo de instrumentos y metodologías que se diferencian en cierto número de ventajas y desventajas frente a un proceso de cuantificación en específico. Entre estas técnicas de análisis, las técnicas electroanalíticas han recibido especial atención por parte de los investigadores alrededor del mundo, debido a que suelen ser rápidas, de bajo costo, de bajo consumo de energía, potencialmente portables y pueden adaptarse para ser selectivas en matrices complejas. Dichas técnicas, se basan en el estudio de reacciones de óxido/ reducción de especies electroactivas sobre una interfase solido-líquido y la relación entre la concentración del analito de interés y magnitudes propias de este proceso, como corriente eléctrica, carga y potencial eléctrico (Ledezma et al., 2011); teniendo como fin último, en muchos casos, la construcción de sensores electroquímicos.
Todo sensor posee dos componentes básicos: un sistema de reconocimiento y un transductor (Agarwal, 2006); siendo el primero el componente responsable del reconocimiento directo, o, indirecto del analito. Para el caso de los biosensores electroquímicos, la unidad detectora consiste en superficies electródicas modificadas con sistemas de reconocimiento biológicos complejos y variados, entre los cuales, las enzimas han sido las especies químicas más utilizadas.
Las enzimas, son moléculas de alto peso molecular, que se encuentran naturalmente en las células de todos los organismos, las cuales tienen por función catalizar reacciones bioquímicas necesarias para mantener el metabolismo, para lo cual, cada enzima debe reaccionar selectivamente con una sustancia en particular llamada sustrato (Veitch, 2004). Es por esto, que las enzimas son candidatos promisorios para la detección selectiva, y en algunos casos, remoción de sustratos o analitos de interés biológico, fisiológico, industrial, etc.
Es posible encontrar, en la literatura, miles de publicaciones basadas en la estructura y funcionamiento de una enzima en particular llamada peroxidasa de rábano, o Horseradish Peroxidase (HRP) (Cheng et al., 2006); la cual, es una enzima glicosilada de peso molecular de 40000 g/mol, que se utiliza a nivel clínico como componente de kits formulados para la realización de inmunoensayos, que permiten detectar algunos virus como el virus de la inmunodeficiencia humana (VIH, por sus siglas en inglés) (Farzin et al., 2020). La HRP, tiene la capacidad de catalizar la oxidación de compuestos orgánicos e inorgánicos en solución acuosa, en presencia de su sustrato peróxido de hidrógeno, H2O2, lo que le ha otorgado una gran versatilidad para ser empleada en procesos de remoción y cuantificación de algunos contaminantes (Ahirwar et al., 2017).
Para el caso de superficies electródicas modificadas con HRP, estas se han empleado con el fin de cuantificar H2O2 (Wang et al., 2007); debido a que es una molécula que cumple un rol importante en un gran número de procesos industriales y biológicos (Ciriminna et al., 2016), desde su uso masivo como blanqueador de telas en la industria textil (Amorim et al., 2002) y su aplicación como descontaminante de aguas de residuo (Bauzá et al., 2014) hasta su monitoreo como un parámetro biológico significativo en el estudio de enfermedades (Crulhas et al., 2016). El H2O2 resalta en investigaciones realizadas en el campo farmacéutico, ya que no sólo es empleada como catalizador para la síntesis de algunos compuestos con propiedades farmacológicas, sino que también se ha relacionado con la incidencia de algunas enfermedades como Alzheimer´s y Parkinson´s, donde niveles altos de H2O2 son generado por el organismo (Al-Hardan et al., 2016; Tabner et al., 2005).
El mecanismo de cuantificación del H2O2 sobre electrodos modificados con HRP, depende en muchos casos de cómo la enzima se estabiliza sobre la superficie del electrodo, o de si es necesario un par redox como mediador de la comunicación eléctrica entre la enzima y la superficie electródica (Chen et al., 2012). En este tipo de dispositivos, las dificultades se han presentado a la hora de lograr métodos óptimos que permitan inmovilizar la enzima sobre dichas superficies por tiempos prolongados; de igual manera, se persigue que los materiales empleados para mantener la enzima inmovilizada, permitan la transferencia de carga directamente entre el centro activo de la HRP y el electrodo sin la ayuda de mediadores redox.
Las tendencias de investigación en la determinación electroquímica del H2O2 sobre biosensores enzimáticos, están enfocadas en la necesidad de materiales capaces de disminuir los sobrepotenciales redox necesarios para la detección del H2O2 a través de una adecuada orientación de la enzima sobre la superficie del electrodo (Chen et al., 2012), donde la enzima redox más estudiadas ha sido la HRP (Tatsuma et al., 1989). Un factor crítico en las reacciones bioelectroquímicas de la HRP es asegurar la orientación y el dinamismo de las enzimas (cambios conformacionales) (Kohen, 2015), ya que la conformación de la proteína alrededor del grupo protésico determinará el potencial redox de la pareja Fe3 + / Fe2 +. Para superar este problema, en las aplicaciones prácticas, el uso de mediadores redox es la estrategia más común (Calvente et al., 2003; Smit & Cass, 1990; Garguilo et al., 1993; Rosca & Popescu, 2002). Algunas investigaciones reseñan que la HRP sobre materiales de carbono es difícil de estudiar electroquímicamente, debido a la contribución de la corriente capacitiva del carbono, lo que limita al sistema en aplicaciones sensoras (Ruzgas et al., 1995) (Andreu et al., 2007). En ese sentido, el uso de nanopartículas de oro para el diseño bioconjugados de electrodos-enzimas, ha llamado la atención por sus propiedades conductoras y catalíticas.
En el presente artículo, se discuten los reportes más destacados sobre superficies electródicas modificadas con nanopartículas de oro y su aplicación en biosensores enzimáticos electroquímicos, para la detección de H2O2, mediante la inmovilización HRP sobre la superficie electródica modificada. Se inicia, con la puesta en contexto del término biosensor y sus generalidades, posteriormente se describen las técnicas de inmovilización de enzimas sobre superficies electródicas y la importancia de los materiales estructurados en esta disciplina. Se profundiza, en el origen de la señal analítica que se obtiene, a través del fundamento de biosensores electroquímicos de tercera generación y luego se hace hincapié en la comunicación eléctrica en este tipo de dispositivo a través de reportes en la literatura sobre electrodos modificados con nanopartículas de oro, que involucran a la HRP y su aplicación en la detección de H2O2.
Biosensores
Los biosensores, son dispositivos analíticos que tienen la capacidad de transformar una respuesta biológica en una señal eléctrica. Idealmente, los biosensores deben ser específicos, independientes de parámetros físicos como el pH y la temperatura, y deben ser portables. La característica principal de estos sistemas es la presencia en el dispositivo de moléculas biológicas que cumplen el papel de sistema de reconocimiento, ya que estas, son las responsables de reaccionar específicamente con el analito de interés. La fabricación de los biosensores, sus materiales y métodos de inmovilización de las sustancias biológicas, se ha logrado gracias al trabajo multidisciplinario de investigadores en áreas tan variadas como Química, Biología e Ingeniería (Mehrotra, 2016).
Los sistemas de bioreconocimiento empleados en la construcción de los biosensores, tomando en cuenta sus mecanismos, se pueden categorizar en tres grupos principales: i) grupo biocatalítico, comprendiendo las macromoléculas enzimáticas; ii) grupo de bioafinidad, incluyendo anticuerpos y ácidos nucleicos; y iii) el grupo basado en microorganismos, como las bacterias (Mehrotra, 2016). Por otro lado, de acuerdo con el fundamento del transductor del biosensor, componente capaz de transformar o convertir la señal de reconocimiento, los biosensores se clasifican en:
-Biosensores ópticos: consisten en una fuente de radiación electromagnética y un cierto número de componentes ópticos, que se emplean para generar un haz de radiación electromagnética con características definidas. La interacción de la radiación con el conjunto analito-molécula biológica, produce cambios en la naturaleza del haz de luz, lo que se utiliza para obtener información del analito de interés.
-Biosensores térmicos: los cuales corresponden, a dispositivos que modifican la magnitud de su resistividad en base a cambios sutiles en la temperatura, estos generados a su vez, por las reacciones enzimáticas que involucran, directa o indirectamente al analito (Ramanathan et al., 1999).
Métodos de inmovilización de enzimas, ventajas y desventajas (Scouten et al., 1995)

-Biosensores piezoeléctricos: se basan en la medida de cambios en la frecuencia de resonancia de cristales piezoeléctricos, generados por alteraciones en su masa y estructura cristalina.
-Biosensores electroquímicos: hacen referencia a electrodos (transductor) cuyas superficies han sido modificadas químicamente con diferentes moléculas biológicas. Las señales analíticas utilizadas a cuantificar corresponden a la carga eléctrica generada por el sistema en las reacciones de óxido-reducción que ocurren entre el analito y la biomolécula empleada. (Thevenot et al., 2001).
De los biosensores mencionados, los más empleados son aquellos que hacen uso de la capacidad catalítica de las enzimas. Existe una amplia variedad de enzimas de orígenes animales o vegetales, lo que ha generado, un área de investigación bastante extensa, con un sinnúmero de sistemas enzima-sustrato que pueden ser analizados con el fin de determinar sus propiedades y sus posibles aplicaciones en la construcción de sensores.
En lo que respecta a los transductores utilizados para la creación de los biosensores enzimáticos, los de naturaleza electroquímica suelen ser los más empleados; debido a las ventajas que representan y aportan al sistema de estudio, por un lado, la señal analítica se obtiene directamente en forma de carga o corriente eléctrica, información que puede ser procesada fácilmente por sistemas computacionales; y, por otro lado, los transductores electroquímicos muestran gran versatilidad, ya que, en su mayoría, es sólo la superficie electródica la que debe ser modificada de acuerdo al analito de interés. Las posibles desventajas de los arreglos electroquímicos radican en la baja selectividad que estos pueden presentar, no obstante (Boujakhrout et al., 2016), la implementación de la enzima minimiza este aspecto, siempre y cuando, la misma sea soportada e inmovilizada de manera efectiva sobre el electrodo.
Un paso crítico en la construcción de cualquier biosensor enzimático corresponde a la inmovilización efectiva de la biomolécula sobre un soporte o matriz que permita, al mismo tiempo, la difusión libre de sustratos y productos hacia adentro y hacia afuera de ese soporte o matriz. De esta manera, el método de inmovilización resulta determinante en la sensibilidad y vida útil del sensor construido. Algunos de los métodos de inmovilización de enzimas más empleados se esquematizan a continuación (Figuras 1- 4), en conjunto con las ventajas y desventajas de cada uno de ellos (Tabla 1).
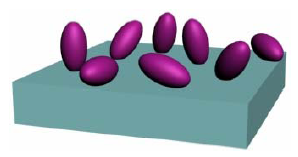
Figura 1.
Inmovilización enzimática por adsorción en matrices insolubles. Enzima ( ) (Ruíz, 2006)
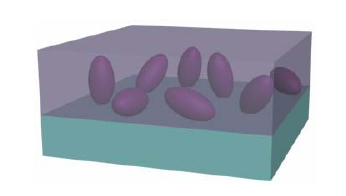
Figura 2
Inmovilización enzimática por Atrapamiento en gel. Enzima ( ) (Ruíz, 2006)
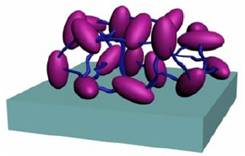
Figura 3
Inmovilización enzimática por entrecruzamiento. Enzima ( ) (Ruíz, 2006)
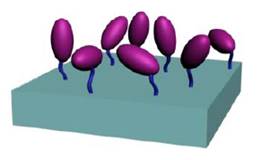
Figura 4.
Inmovilización enzimática por enlace covalente. Enzima ( ) (Ruíz, 2006)
Características generales de la HRP
La HRP, es una oxidoreductasa perteneciente al grupo de las ferri-hemoproteínas, que ha sido estudiada extensivamente a lo largo de los años y ha mostrado gran utilidad en el campo de la biotecnología. Su sustrato corresponde al peróxido de hidrógeno inorgánico y a algunos peróxidos alquílicos que son reducidos químicamente. (Lopes et al., 2014). Estructuralmente, esta enzima consiste en 308 aminoácidos, 4 puentes disulfuro entre residuos de cisteína, dos átomos de calcio y un átomo de hierro (III) como centro metálico de un grupo hemo. La estructura tridimensional de esta biomolécula es principalmente helicoidal α, con sólo una pequeña fracción con estructura de hojas β (Lopes et al., 2014). La HRP, en su función como oxido-reductasa sigue el siguiente esquema de reacción:
 (Ec.1)
(Ec.1)La reacción (Ec.1), implica la oxidación del grupo ferrihemo, generando como producto al compuesto I con estado de oxidación +5. Este compuesto es un grupo oxiferrilo (Fe4+=O) y un radical catiónico porfirínico π. En la reacción (Ec.2) el compuesto I es reducido por un dador de electrones AH2 para producir el compuesto II con estado de oxidación +4. Por último, la reacción (Ec.3) muestra la captación de electrones por parte del compuesto II para regenerar la enzima hasta ferriperoxidasa (enzima nativa).
Cuando la HRP se inmoviliza sobre la superficie de un electrodo, la regeneración de su forma nativa se puede propiciar por dos vías; la primera es la reducción del compuesto I a compuesto II y de este último a la enzima nativa, vía intercambio de un electrón en cada etapa (total 2e-); la segunda vía es utilizar mediadores redox, como ferrocianuro, yoduro o fenoles (Dunford & Adeniran, 1986). Estos mediadores poseen altas velocidades de transferencia electrónica y se utilizan en este tipo de biosensores con el fin de minimizar el efecto en el sistema de la lenta transferencia de electrones por parte de las enzimas. (Ruzgas et al., 1996). En la Figura 5, se muestra los ciclos de oxidación de la HRP en presencia o ausencia de H2O2.
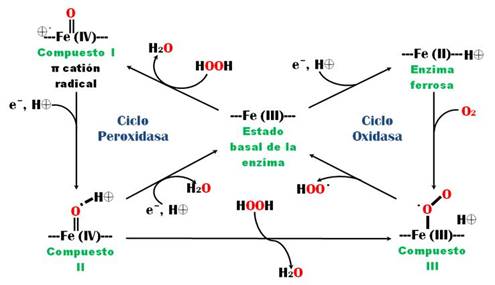
Figura 5
Mecanismo de oxidación de la HRP en su ciclo oxidasa, en ausencia y presencia del sustrato (Gunnar et al., 2002)
A pesar de la ambigüedad de algunas de las definiciones disponibles en la literatura, se suele aceptar como nanoestructuras aquellas partículas de sustancias orgánicas o inorgánicas, que poseen dimensiones con longitudes menores a 100 nanómetros.
En las últimas décadas, se ha realizado y documentado un gran número de investigaciones en el área de síntesis y caracterización de materiales a nano-escala, lo que ha permitido obtener conocimiento a profundidad, de la relación que existe entre las propiedades y características únicas de las nano-partículas, su tamaño, forma y composición. (Fahad et al., 2012).
Particularmente, la gran área superficial que exhiben estos materiales a nano-escala, en conjunto con propiedades eléctricas y electrónicas que los diferencian de sus pares a escala macro, le han otorgado un sin número de aplicaciones potenciales en diferentes áreas de la Biología, Química, Medicina, etc.
Hasta la fecha, existen diferentes formas y sistemas de clasificación de nanomateriales sintetizados. Sin embargo, una de las clasificaciones más generales se basa en el número de dimensiones que posee el nanomaterial:
-Materiales cero-dimensionales (0-D): aquellos materiales que poseen todas sus dimensiones dentro de la escala nanométrica. Sus representantes más comunes son las nanopartículas esféricas, las cuales pueden ser, amorfas o cristalinas, metálicas, cerámicas o poliméricas (Jitendra et al., 2012). Ejemplos se muestran en la Figura 6.

Figura 6
Microscopías de barrido (SEM) y de transmisión (TEM) de diferentes materiales 0-D. A) Puntos cuánticos, B) arreglo de nanopartículas, C) nanopartículas "core-shell", D) nanocubos huecos, E) nanoesferas (Jitendra et al., 2012)
-Materiales uno-dimensionales (1-D): correspondientes a las estructuras que poseen una de sus dimensiones fuera de la escala nanométrica. Esto lleva a materiales con forma de tubos o alambres, cuya composición, al igual que en las nanopartículas, puede ser cerámica, metálica o polimérica (Jitendra et al., 2012). Ejemplos se observan en la Figura 7.

Figura 7
Microscopías de barrido (SEM) de diferentes materiales 1-D. A) Nano-alambres, B) nanobarras, C) nanotubos, D) nanocinturones, E) nanocintas, F) nanoestructuras jerárquicas (Jitendra et al., 2012)
-Materiales dos-dimensionales (2-D): debido a que poseen dos de sus dimensiones fuera de la escala nanométrica. Los materiales 2-D muestran forma de láminas o platos. Estructuras de este tipo son llamadas nanopelículas, nanocapas, nanohojas, etc. (Jitendra et al., 2012). Ejemplos se observan en la Figura 8.

Figura 8.
Microscopías de barrido (SEM) y de transmisión (TEM) de diferentes materiales 2-D. A) Nanoislas contiguas, B) nanoramas, C) nanoplatos, D) nanohojas, E) nanoparedes, F) nanodiscos (Jitendra et al., 2012)
-Materiales tres-dimensionales (3-D): hace referencias a estructuras más complejas, formadas por la unión o aglomerado de subunidades pertenecientes a las clasificaciones anteriores. Es posible incluir dentro de esta clasificación, a dispersiones de nanopartículas (O-D) y "nanoárboles" compuestos de la unión de nanoalambre o nanotubos 2-D. Ver Figura 9.

Figura 9.
Microscopías de barrido (SEM) y de transmisión (TEM) de diferentes materiales 3-D. A) Nanobolas (con estructuras dendríticas), B) nanobobinas, C) nanoconos, D) nanopilas, E) nanoflores (Jitendra et al., 2012)
Las nanopartículas de oro (AuNPs), corresponden a unas de las primeras nano-estructuras en ser sintetizadas y reportadas en la literatura; las más comunes son aquellas de forma esférica (0-D), donde se han reportado diámetros muy variados (Herizchi et al., 2014). El Au, en dimensiones de nanopartículas presenta varias ventajas sobre el uso de otros metales; no sólo es un material que conduce de forma muy eficiente la electricidad, también su carácter de metal noble las hace biocompatible con moléculas orgánicas complejas y que resultan no toxicas dentro de los organismos vivos. De la misma manera, las soluciones coloidales de las nano-Au, presentan plasmones de resonancia intensos que las hacen candidatas para la elaboración de sensores ópticos y su alta conductividad eléctrica para sensores electroquímicos. El uso de AuNPs, en matrices que soportan enzimas se encuentra sustentado, en que en ellas las biomoléculas no corren el riesgo de desnaturalizarse.
Nanopartículas de oro y Biosensores electroquímicos de 3era generación (Fernández et al., 2019)
La evolución de los biosensores electroquímicos enzimáticos de tercera generación se refleja en las mejoras de la superficie del transductor, como resultado de la incorporación de nanomateriales en su superficie. Variedad de nanomateriales, se han utilizado en estos biosensores, donde entre sus funciones específicas se encuentran: i) inmovilización de biomoléculas; ii) proporcionar un medio adecuado donde se desarrolle la catálisis de reacciones bioelectroquímicas; iii) facilitar la transferencia de electrones; iv) marcar las biomoléculas y v) actuar como reactivo electroactivo.
Nanopartículas de Ag y Au, debido a buena bicompatibilidad, facilitan la estabilidad del sistema biológico de reconocimiento (Zhuo et al., 2005); nanopartículas de semiconductores, tales como CdS y PbS, debido a su facilidad de mediación son capaces de mejorar la sensibilidad y detección indirecta del analito (Cai et al., 2002); así como materiales de metales nobles nanoparticulados de Au y Pt pueden favorecer la selectividad debido a sus dimensiones nanométricas (Xiao et al., 2003; Fiorito et al., 2005; Cai et al., 2002; Xu et al., 2005).
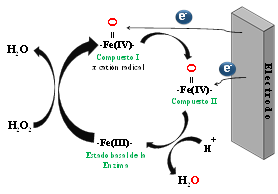
Figura 10
Mecanismos de oxidación de la HRP en su ciclo oxidasa (en ausencia del sustrato) y el ciclo peroxidasa (en presencia del sustrato) (Fernández et al., 2019)
El ciclo catalítico de la enzima, sobre la superficie de un transductor electroquímico, se muestra en la Figura 10. En los biosensores de tercera generación, los electrones se transfieren directamente desde el grupo protésico de la enzima redox a la superficie del electrodo, sin intervención de moléculas redox mediadoras en el proceso. Los diseños electródicos más simple (Csöregi et al., 1993), utilizan el monitoreo directo de la transferencia electrónica de la peroxidasa, a través de corrientes generadas por la reducción sobre el transductor, de los Compuestos I y II, Ec. 1-3, a potenciales más negativos de 0,6 V versus electrodo de calomel saturado (SCE, por sus siglas en inglés).
La velocidad del proceso cinético descrito, es muy lenta sobre electrodos convencionalmente como Pt, Au, C, Pd, etc. Por lo cual, para aumentar dicha velocidad, se utilizan mediadores redox moleculares que reaccionan rápidamente con la peroxidasa. Ejemplos de estos mediadores: aminas aromáticas, compuestos fenólicos, hexacianoferrato (II), yoduros, ascorbatos, etc. (Gorton, 1995), los cuales pueden estar presente en disolución o inmovilizados sobre el transductor, (Figura 11).
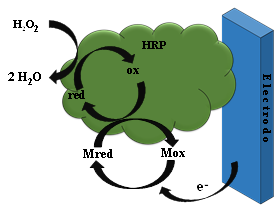
Figura 11.
Secuencia de reacción de la HRP inmovilizada sobre un electrodo. M = mediador (Fernández et al., 2019)
El uso de AuNPs, facilita el desarrollo y el diseño de biosensores electroquímicos de 3era generación que utilizan peroxidasas, por lo que se han realizado grandes esfuerzos para facilitar la transferencia directa de electrones entre la enzima redox y la superficie del electrodo. AuNPs funcionalizadas con compuestos organosulfurados (Colangelo et al., 2017; Kutsenko et al., 2017), han llamado la atención principalmente por sus propiedades catalíticas, alta reactividad y capacidad para unir reacciones bioquímicas con transducción de señales eléctricas (Bolat et al., 2013; Koposova et al., 2015; Ma et al., 2009; Abi & Ferapontova, 2012; Ahirwal & Mitra, 2009). En la literatura, existe poca discusión y análisis sobre parámetros esenciales como la carga enzimática, el área cubierta de nanomaterial y la capacidad de restitución de la enzima a su forma nativa (Huerta et al., 2018). En ese sentido G. A. Huerta-Miranda et al. (2018), utilizaron AuNPs y 4-aminotiofenol como soportes para obtener una matriz adecuada para la bioconjugación de la HRP. Sus resultados muestran que la distancia entre las enzimas y a su vez entre ellas y el electrodo es esencial.
En los últimos años, se ha investigado diferentes estrategias de inmovilización de las enzimas peroxidasas, principalmente sobre electrodos de oro y grafito, que utilizan la fisioadsorción (Castillo et al., 2006), monocapas auto ensambladas (Gaspar et al., 2000) y matrices de gel de polímeros redox (Gaspar et al., 2001).
Las tendencias de investigación en la determinación electroquímica del H2O2 sobre biosensores electroquímicos enzimáticos, se enfocan en necesidad de materiales capaces de disminuir los sobrepotenciales redox necesarios para la detección del H2O2, sin el uso de mediadores, a través de una adecuada orientación de la enzima sobre la superficie del electrodo (Chen et al., 2012). Un factor crítico en las reacciones bioelectroquímicas de la HRP, es asegurar la orientación y el dinamismo de las enzimas, lo que se traduce en el control de los cambios conformacionales (Kohen, 2015); ya que la conformación de la proteína alrededor del grupo protésico determinará el potencial redox de la pareja Fe3+/Fe2+. Para superar este problema, en las aplicaciones prácticas, el uso de mediadores redox es la estrategia más común (Calvente et al., 2003; Smit & Cass, 1990; Garguilo et al., 1993; Rosca & Popescu, 2002). El uso de 4-aminotiofenol (Huerta et al., 2018) como andamiaje es una interfaz multicapa que permitió el desarrollo de matrices adecuadas para la catálisis y la bioconjugación con la HRP. Los estudios voltamétricos mostraron un comportamiento electroquímico reversible de la enzima cuando se inmovilizó en un depósito de oro bien disperso. La catálisis del H2O2 y el comportamiento enzimático se analizaron considerando dos tipos de disposiciones de nanopartículas: oro bien disperso y electrodepositado al azar. El comportamiento catalítico observado en la configuración de nanopartículas bien dispersas, sugiere que el plegamiento de la enzima se conserva en esta conformación, a través la disminución de los impedimentos estéricos que facilita la transferencia de electrones enzimática directa. En contraste, el electrodo con oro electrodepositado al azar disminuyó la orientación de la enzima y su actividad electroquímica. Estudios realizados por Yang et al. (2017), indican la transferencia electrónica directa de la HRP sobre la superficie del electrodo, a través de su inmovilización en un electrodo de carbono vítreo (GCE, por sus siglas en inglés) durante el proceso de deposición de AuNPs con la ayuda del surfactante bromuro de cetil-trimetilamonio (CTAB, por sus siglas en inglés), generando el electrodo modificado HRP-CTAB-AuNPs/GCE. El sensor, HRP-CTAB-AuNPs/GCE, pudo catalizar directamente la reducción de peróxido de hidrógeno, hidroperóxido de ter-butilo y el hidroperóxido sin necesidad de mediadores. Los resultados mostraron que el sensor exhibió buenos límites de detección.
Particularmente, cuando se trabaja con biosensores basados en AuNPs, el método de inmovilización de la enzima en la superficie del electrodo debe ser cuidadosamente seleccionado, ya que cada método de inmovilización tiene tanto ventajas como desventajas que afectan el diseño HRP- AuNPs.
De acuerdo a los reportes de Yang et al. (2017), en el caso de la inmovilización de la HRP sobre AuNPs por reticulación y unión covalente, puede lograrse la inmovilización estable de la enzima y el uso de los residuos de aminoácidos de la HRP afectará menos la actividad de la enzima. La adsorción física, como método simple de inmovilización, preserva la actividad enzimática en condiciones moderadas. Sin embargo, las fuerzas débiles no favorecen la interacción entre la enzima y el electrodo. El atrapamiento de la enzima dentro de una matriz tiene la ventaja mantener la actividad enzimática y la estabilidad relativamente alta de la enzima inmovilizada, pero las estructuras de la matriz dificultan la transferencia de masas y por ende de los electrones. En presencia de AuNPs, la inmovilización por fuerzas electrostática puede proporcionar una forma más eficiente de inmovilización, debido a que la interacción electrostática es más fuerte que la adsorción física y más suave que la reticulación y la unión covalente. Por otro lado, la literatura reporta que para lograr una transferencia directa de electrones efectiva en los biosensores basados en HRP y AuNPs, generalmente hay que modificar previamente la base de los electrodos para poder integrar las AuNP previamente sintetizadas y las enzimas en el diseño definitivo, lo cual constituye un laborioso trabajo de modificación. Qijin Wan (2013) construyó un electrodo tridimensional mediante una deposición electroquímica in situ de AuNPs, sobre un electrodo de oro recubierto con una monocapa autoensamblada de ácido 3-mercaptopropiónico (Au NP/ MPA/Au). La inmovilización de la HRP en este electrodo, llevó a la comunicación electrónica directa de HRP con la superficie del electrodo. La constante aparente de Michaelis-Menten fue de 0,78 mM, lo que indica una alta actividad enzimática de la HRP sobre la superficie. Ekaterina Koposova et al. (2014), describieron el uso de nanocables y AuNPs, preparados por síntesis de oleilamina y su ensamblaje con la HRP, para la detección bioelectroquímica de H2O2. La sensibilidad, el rango de concentración de trabajo, la reproducibilidad de medición a medición, así como la estabilidad, de este sensor se mejoraron significativamente en comparación a los sensores planos de películas delgadas. Los estudios muestran, que los "nanocables" de oro ultrafinos y las nanopartículas preparadas por la síntesis de oleilamina son materiales prospectivos para ensamblar biomoléculas en nanoarquitecturas funcionales para sensores bioelectroquímicos basados en enzimas.
Liu et al. (2012), logró la comunicación eléctrica directa de la HRP con un electrodo de carbono vítreo sobre el cual se ensamblo Nafion, nanotubos de titanato (GNPs-TNT), un líquido iónico a temperatura ambiente (RTIL) y nanotubos de AuNPs (GNPs-TNT). El compuesto de RTIL y GNPs-TNT se inmovilizaron en la superficie del electrodo a través de la gelificación de una pequeña cantidad de solución acuosa de HRP. Por espectroscopia UV-Vis e IR, se demostró que la HRP en el composito conservó su estructura nativa secundaria y su actividad bioquímica. Los resultados por Voltametría y Cronoamperometría, mostraron que la transferencia de electrones directa entre el electrodo modificado con nanocompuestos y el grupo hemo en HRP es eficiente. El biosensor respondió al H2O2 con un límite de detección de 2,1 × 10−6 mol L − 1 (basado en S / N = 3). Igualmente, para la detección amperométrica de H2O2, Yu et al. (2015) fabricó una interfaz de óxido de grafeno (GO, por sus siglas en inglés) con AuNPs para inmovilizar la HRP. Debido a la biocompatibilidad de las AuNPs y la gran área de superficie del GO, la HRP inmovilizada conservó su bioactividad y exhibió un rendimiento notable para la detección de H2O2. Ventajas analíticas tales como límite de detección bajo, amplio rango lineal y tiempo de respuesta rápido cumplieron con el requisito de medición en tiempo real de H2O2 celular en células vivas. Donde, los resultados indicaron que los niveles de H2O2 intracelular dependían de los tipos de células. Este enfoque proporcionó una plataforma simple y efectiva para detectar H2O2 dentro de células biológicas que podría usarse para el estudio de los procesos biológicos dinámicos involucrados con el H2O2. Boujakhrout et al. (2016), utilizó AuNPs modificadas con 4-mercaptopiridina y 6-mercapto-1-hexanol como agentes de coordinación para preparar un nanomaterial híbrido. Este nanohíbrido se empleó para modificar electrodos de carbono vítreo y construir un biosensor amperométrico, sin mediadores, basado en HRP para H2O2. El electrodo, posicionado a -100 mV, mostró una respuesta rápida en 4 s y un rango de calibración lineal de 90 pM a 6,5 nM de H2O2. En esta misma línea Farzana et al. (2013), propone una plataforma de detección para el estudio de la cinética enzimática de la HRP utilizando AuNPs dispersas en una película de dendrímero de trimetoxisilil PAMAM-OS, autoensamblada sobre electrodos de óxido de estaño e indio (ITO, por sus siglas en inglés). Para la inmovilización de una enzima se utilizó una capa de quitosano integrada en las AuNPs. La estrategia utilizada para la modificación, resultó en un nuevo biosensor amperométrico de tercera generación para la detección de H2O2. Se comprobó la influencia de las AuNPs, debido al aumento de la carga de moléculas de enzimas activas en el ensamblaje y a la amplificación de la actividad catalítica. La sensibilidad y la estabilidad de la enzima son los objetivos principales en la mejora de los biosensores; Ospina et al. (2016), lo lograron mediante la combinación de dos electrocatalizadores: ferroceno y AuNPs. Las AuNPs se sometieron a electrodeposición sobre el polifenil policiclosiloxano (FPP, por sus siglas en inglés). La superficie desarrollada se comparó con las obtenidas con electrodos modificados con GO, debido a su área específica muy alta. El estudio cinético de electrodos modificados con y sin HRP, mostró que el sistema FPP/AuNPs mejora en gran medida otros sistemas más complejos basados en la electro-reducción directa de HRP por los AuNPs, permitiendo el uso de potenciales de medición más bajos, con sensibilidad mejorada, rangos lineales más amplios y niveles más bajos de detección. La constante de Michaelis-Menten obtenida fue de 0,32 mM, significativamente más baja que la constante intrínseca, revelando la muy alta eficiencia enzimática del dispositivo desarrollado. El nuevo dispositivo se utilizó con éxito en la determinación de hidroperóxidos orgánicos.
La presente revisión, muestra los grandes esfuerzos que se han realizado para facilitar la transferencia de electrones entre la HRP inmovilizadas sobre AuNPs y la superficie electródica. Modificadores superficiales, tanto orgánicos como inorgánicos, sobre el transductor electroquímico (electrodo), definitivamente deben integrase a la arquitectura que conforma a la AuNPs, los cuales aportan ventajas como biocompatibilidad y gran área superficial; propiedades que al unirse con la buena conductividad de las AuNPs pueden proporcionar un microentorno adecuado para que la enzima redox intercambie electrones con el transductor de una manera eficiente. En general, la modificación de electrodos con AuNPs en la construcción de sensores electroquímicos para la detección de H2O2, sigue las dos categorías establecidas en la literatura: a) biosensores para la detección de H2O2 basados en la inmovilización de la enzima, cuya comunicación eléctrica es mediada por las AuNPs en un ambiente orgánico o inorgánico y b) sensores basados en la determinación directa de H2O2 sobre electrodos modificados solo con AuNPs. Hasta los momentos de esta revisión, el segundo método tiene superioridad al poder superar el inconveniente de la efectiva comunicación eléctrica que demanda el dispositivo, pero la inactivación y la fuga, a partir de la superficie electródica, de la proteína y/o los mediadores en pocos reportes puede ser superado por esta configuración. En contraste, el primer método puede ofrecer ambientes biocompatibles al transductor enzimático, con materiales sinérgicos efectivos que potencias dicha ventaja evitando la inactivación y la fuga, a partir de la superficie electródica, de la proteína y/o los mediadores. Lo anterior, es objeto de innumerables estudios en la literatura.
Métodos de inmovilización de enzimas, ventajas y desventajas (Scouten et al., 1995)


Figura 1.
Inmovilización enzimática por adsorción en matrices insolubles. Enzima ( ) (Ruíz, 2006)

Figura 2
Inmovilización enzimática por Atrapamiento en gel. Enzima ( ) (Ruíz, 2006)

Figura 3
Inmovilización enzimática por entrecruzamiento. Enzima ( ) (Ruíz, 2006)

Figura 4.
Inmovilización enzimática por enlace covalente. Enzima ( ) (Ruíz, 2006)

Figura 5
Mecanismo de oxidación de la HRP en su ciclo oxidasa, en ausencia y presencia del sustrato (Gunnar et al., 2002)

Figura 6
Microscopías de barrido (SEM) y de transmisión (TEM) de diferentes materiales 0-D. A) Puntos cuánticos, B) arreglo de nanopartículas, C) nanopartículas "core-shell", D) nanocubos huecos, E) nanoesferas (Jitendra et al., 2012)

Figura 7
Microscopías de barrido (SEM) de diferentes materiales 1-D. A) Nano-alambres, B) nanobarras, C) nanotubos, D) nanocinturones, E) nanocintas, F) nanoestructuras jerárquicas (Jitendra et al., 2012)

Figura 8.
Microscopías de barrido (SEM) y de transmisión (TEM) de diferentes materiales 2-D. A) Nanoislas contiguas, B) nanoramas, C) nanoplatos, D) nanohojas, E) nanoparedes, F) nanodiscos (Jitendra et al., 2012)

Figura 9.
Microscopías de barrido (SEM) y de transmisión (TEM) de diferentes materiales 3-D. A) Nanobolas (con estructuras dendríticas), B) nanobobinas, C) nanoconos, D) nanopilas, E) nanoflores (Jitendra et al., 2012)

Figura 10
Mecanismos de oxidación de la HRP en su ciclo oxidasa (en ausencia del sustrato) y el ciclo peroxidasa (en presencia del sustrato) (Fernández et al., 2019)

Figura 11.
Secuencia de reacción de la HRP inmovilizada sobre un electrodo. M = mediador (Fernández et al., 2019)


