Resumen:
Introducción: la Ochroma pyramidale es una especie con alto potencial restaurador y se adapta fácilmente en áreas perturbadas; sin embargo, la germinación de la semilla se ve afectada por ser ortodoxa y experimentar latencia.
Vacío de conocimiento: variación de la capacidad germinativa entre distintos tratamientos y condiciones ambientales.
Propósito del estudio: evaluar el porcentaje de germinación de semillas de O. pyramidale por medio de diferentes métodos de escarificación química.
Metodología: se aplicó un diseño experimental de tres bloques, tres repeticiones y 15 unidades de ensayos. Los tratamientos fueron: T1 (agua caliente a 80°C), T2 (NaCIO al 0,5%), T3 (NaCIO al 1,0%), T4 (NaCIO al 2,0%), T5 (HCl al 1%).
Resultados y conclusiones: la germinación de semillas de O. pyramidale en todos los tratamientos inició al cuarto día después de la siembra con algunas diferencias de semillas germinadas entre tratamiento con respecto al primer día de germinación con algunas variaciones entre tratamientos. El mayor porcentaje de germinación ocurrió en el tratamiento 1 (T1) con 88 semillas (59%), seguido del tratamiento 2 (T2) con 65 (43%). El tratamiento 1 (agua 80°C) tuvo mayor influencia en la germinación de semillas de O. pyramidale. Por lo tanto, se concluyen que los tratamientos por ebullición no solo contribuyen en el incremento de la germinación, sino que además las semillas logran mayor velocidad germinativa.
Palabras clave: escarificación química, semillas, germinación, latencia.
Abstract:
Introduction: Ochroma pyramidale is a species with high restorative potential and adapts easily in disturbed areas; however, seed germination is affected by being orthodox and experiencing dormancy.
Knowledge gaps: Variation in germination capacity between different treatments and different environmental conditions.
Purpose: To evaluate the germination percentage of O. pyramidale seeds by means of different chemical scarification methods.
Methodology: An experimental design of three blocks, three replicates and 15 test units was applied. The treatments were: T1 (hot water at 80°C), T2 (0.5% NaCIO), T3 (1.0% NaCIO), T4 (2.0% NaCIO), T5 (1% HCl).
Results and conclusions: Germination of O. pyramidale seeds in all treatments started on the fourth day after sowing with some differences in germinated seeds between treatments with respect to the first day of germination with some variations between treatments. The highest percentage of germination occurred in treatment 1 (T1) with 88 seeds (59%), followed by treatment 2 (T2) with 65 (43%). Treatment 1 (water 80°C) had the greatest influence on the germination of O. pyramidale seeds. Therefore, boiling treatments not only contributed to increase germination, but also the seeds achieved a higher germination rate.
Keywords: chemical scarification, seeds, germination, dormancy.
ÁREA AMBIENTAL
MÉTODOS DE ESCARIFICACIÓN QUÍMICA Y SUS EFECTOS EN LA GERMINACIÓN DE SEMILLAS DE Ochroma pyramidale (Cav. ex Lam.) Urb.
METHODS OF CHEMICAL SCARIFICATION AND THEIR EFFECTS ON THE GERMINATION OF SEEDS OF Ochroma pyramidale (Cav. ex Lam.) Urb.
Recepción: 14 Mayo 2020
Aprobación: 08 Agosto 2020
Publicación: 23 Diciembre 2020

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
autores
Los ecosistemas tropicales alojan la mayor diversidad biológica del planeta en casi todas las formas de vida (Gentry, 1988; Gaston, 2000; Hartshorn, 2002). La gran diversidad se debe a condiciones geográficas, ambientales y complejidad ecológica (Duivenvoorden, 1995; Gentry, 1998; Hartshorn, 2002). Por esto, la variedad de especies vegetales y animales que albergan estos ecosistemas favorecen el sostenimiento de la vida (Galeano, 2000; Hartshorn, 2002). A nivel global los ecosistemas naturales están siendo amenazados por actividades antrópicas de tipo extractivista (Patnaik, 2018; Agus et al., 2020), como deforestación, ganadería, minería y asentamiento humano, las cuales implican cambio de uso del suelo (Etter et al., 2008; Shi et al., 2009; Agus et al., 2020). Estas actividades generan transformación del paisaje, pérdida de servicios ecosistémicos y contaminación( Marrugo-Negrete et al., 2015b; Valois-Cuesta & Martínez-Ruiz, 2016; Patnaik, 2018). Esta problemática despierta interés por el desarrollo de investigaciones enfocadas a demostrar los efectos de actividades económicas sobre el ambiente y sus componentes, como también proponer alternativas de gestión (Shi et al., 2009; Marrugo-Negrete et al., 2015b; Valois-Cuesta & Martínez-Ruiz, 2016; Palacios-Torres et al., 2018).
Una alternativa de mitigación ha sido y sigue siendo la recuperación de ecosistemas a través de especies forestales con potencial restaurador (Marenco et al., 2003); sin embargo, existen especies que tienen semillas ortodoxas, es decir, tiene cubierta dura lo cual dificulta la aceleración de su germinación tal como ocurre con O. pyramidale (Herrera & Alizaga, 1999). O. pyramidale ha sido objeto de múltiples estudios debido a su importancia ecológica y su potencial para recuperar áreas degradadas (Whitmore & Wool‐Khoon, 1983; Toledo-González et al., 2019). Tiene amplia distribución geográfica que va desde las Antillas, suroeste de México, Ecuador, Colombia, Brasil y Bolivia (Sandi & Flores, 2010) y es pionera e indicadora de paisajes degradados y recién perturbado (Whitmore & Wooi-Khoon, 1983; Marenco et al., 2003).
Muchos de los estudios han estado enfocados a probar diferentes métodos para acelerar la germinación con el propósito de elegir y proponer el método más apropiado para facilitar procesos de restauración (Whitmore & Wooi-Khoon, 1983; Toledo-González et al., 2019). Los principales métodos empleados para la germinación de semillas de O. pyramidale han sido el físico (agua a 80°C) y químico (ácido sulfúrico)(Herrera & Alizaga, 1999). Adicionalmente, dentro de los métodos pre-germinativos más utilizados son el físico que consiste en raspar o lijar la semilla, y biológico el cual consiste en remojar las semillas en agua (Camacho et al., 2018). En cuanto a la efectividad de los métodos, la mayoría de los estudios documentan que por medio de métodos físicos a temperatura > 60°C se logran porcentajes de germinación entre el 64 (Herrera & Alizaga, 1999) y 68% (Toledo-González et al., 2019). Este interés se debe en gran parte a que la semilla por ser ortodoxa y tener latencia física, presenta dificultad de germinación (Herrera & Alizaga, 1999; Jiménez et al., 2017).
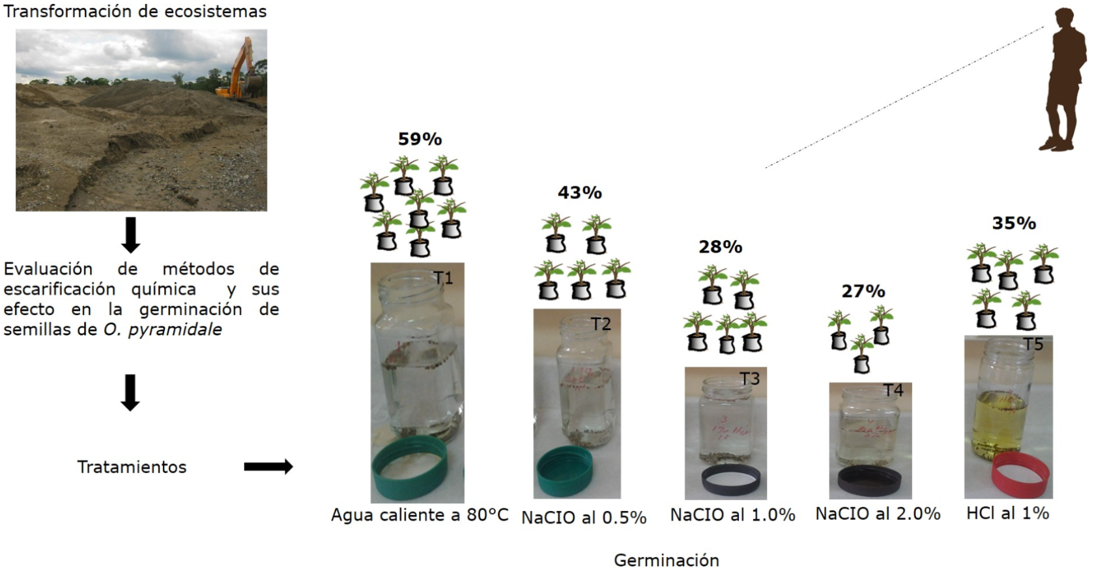
A pesar de las múltiples investigaciones que existente sobre el tema, aún se requiere información sobre la variación de la capacidad germinativa en distintos tratamientos y bajo diferentes condiciones ambientales (Espitia et al., 2016; Toledo-González et al., 2019). Este estudio tuvo como objetivo evaluar el efecto de diferentes métodos de escarificación química en la germinación de semillas de O. pyramidale aplicando cinco tratamientos: T1 (agua caliente a 80°C), T2 (hipoclorito de sodio NaCIO 0,5%), T3 (hipoclorito de sodio NaCIO 1,0%), T4 (hipoclorito de sodio NaCIO 2,0%) y T5 (ácido clorhídrico HCl al 1%). Particularmente, el estudio experimental responde a la necesidad de generar información útil para la toma de decisión en torno a la recuperación ambiental.
El estudio se realizó en el municipio de Quibdó capital del departamento del Chocó, Colombia. Quibdó se ubica geográficamente 5°41′32″ N y 76°39′29″O (Figura 1) y ecológicamente corresponde a las zonas de vida de bosque muy húmedo tropical (bmh- T) y bosque pluvial tropical (pb-T). Se caracterizan por altas precipitaciones y temperaturas superiores a 24°C (Holdridge, 1967). Se registran precipitaciones entre 5.000 y 10.000 mm al año. Una evaporación media variada durante el año. Los meses de mayor evaporación son abril (140,2 mm) y septiembre (146,3 mm)(Gómez & Cadena, 2018).
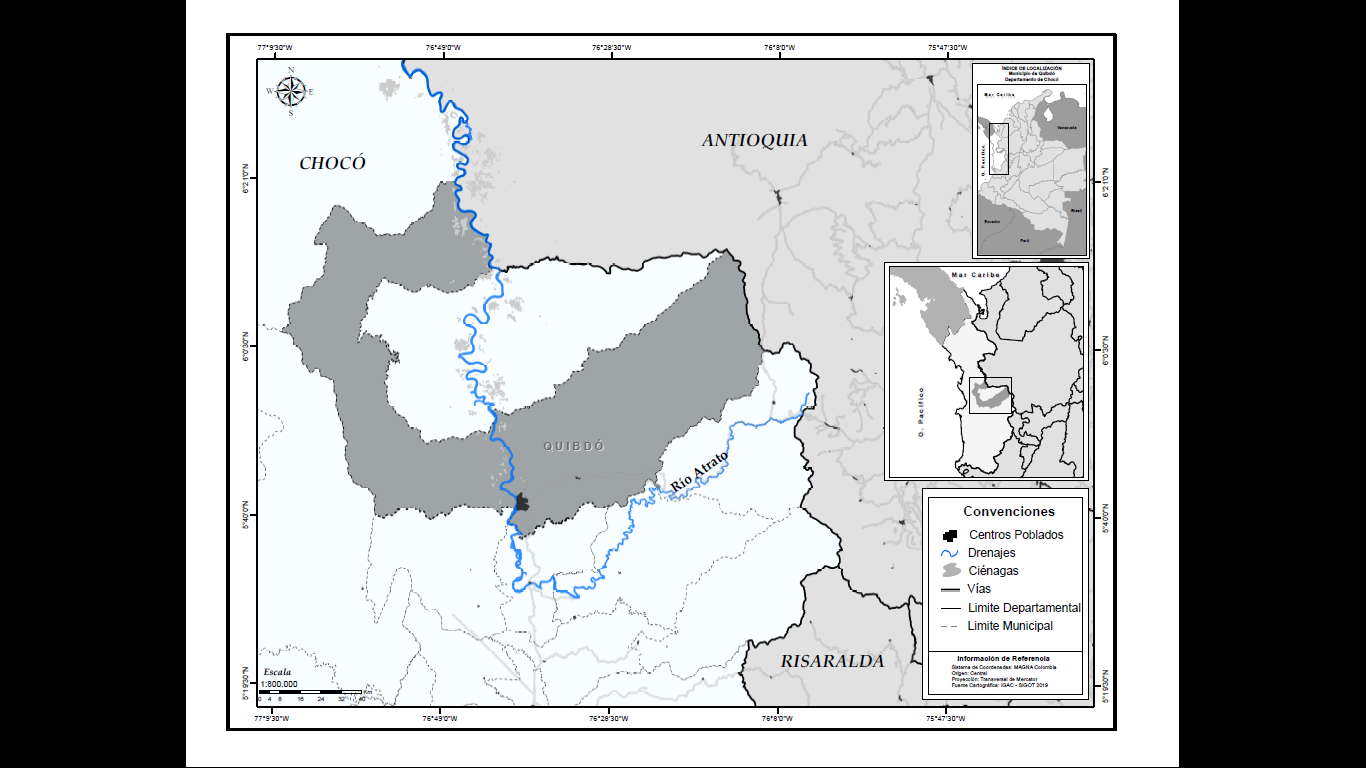
Figura 1.
Ubicación geográfica del área de estudio.
Elaborado por el Geógrafo Juan Camilo Ospino Contreras.
Se aplicó un diseño de tres bloques completamente aleatorio y tres repeticiones. El estudio se realizó mediante cinco fases descritas a continuación en la figura 2. La fase 1 consistió en la adquisición de las semillas. Se obtuvieron semillas certificadas de la tienda agro SEMICOL S.A.S, Bogotá. En la fase 2, se construyó un vivero con techo de plástico temporal de 5,25m2 con dimensiones de 3,5 m de largo por 1,5 m de ancho, en el cual se establecieron tres bloques de 1m de ancho por 1m largo.
En la fase 3, se desarrolló el proceso de escarificación química aplicando cinco tratamientos (T1, T2, T3, T4, T5) en el laboratorio del grupo de investigación “Sistemas Productivos de la Universidad Tecnológica del Chocó”. El T1 consistió en someter las semillas en agua caliente a 80°C hasta enfriar. Después, se dejaron en remojo con agua a temperatura ambiente durante dos días cambiándoles el agua diariamente. T2 se remojaron en solución de hipoclorito de sodio NaCIO al 0,5% durante 15 minutos. Luego se vertió la solución junto con las semillas sobre un colador de malla de alambre y se lavó con agua hasta que el olor a cloro desapareciera. Posteriormente, se colocaron en remojo con agua expuestas a temperatura ambiente durante dos días. En el T3 y T4 se aplicó el mismo procedimiento con la diferencia de concentración NaCIO al 1,0% por 15 min y NaCIO al 2,0% por 15 min respectivamente. Por último, en el T5 las semillas se remojaron en ácido clorhídrico HCl al 1% durante 1 minuto. Se vertió la solución junto con las semillas sobre un colador de malla de alambre y se lavó con agua hasta que el olor a cloro desapareciera. Luego se pusieron en remojo con agua a temperatura ambiente durante dos días.
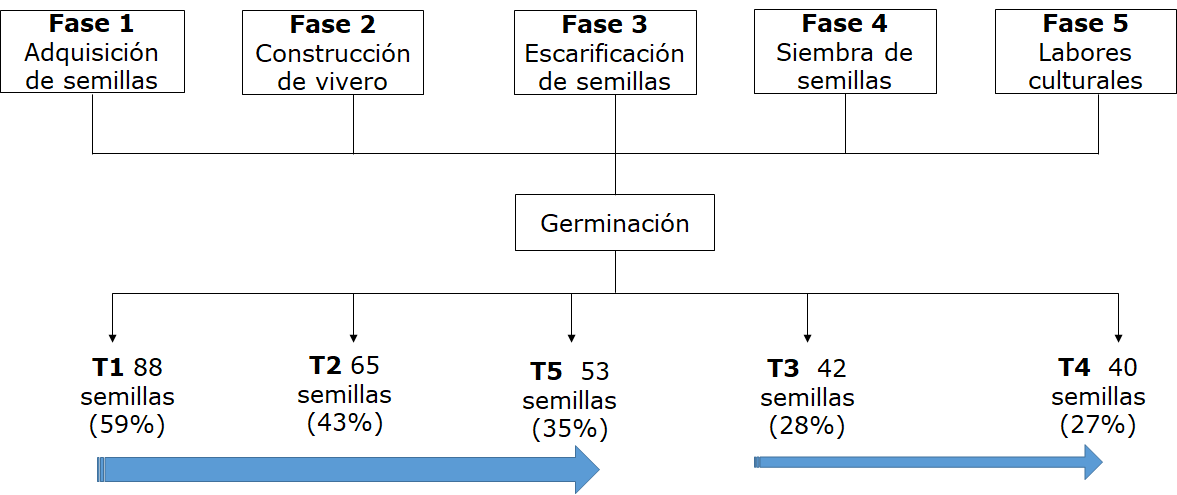
Figura 2.
Metodología del ensayo. Las flechas en color azul indican los porcentajes de mayor a menor en función a los tratamientos aplicados.
Autores.
La fase 4 consistió en la siembra de semillas. En cada tratamiento se sembraron 50 semillas y 250 en cada bloque para un total de 750 semillas. Las distancias de siembra fueron de 2 cm entre semilla y 2 cm entre surco dando como resultado de 15 unidades experimentales (Figura 3). Se utilizó como único sustrato arena sencilla desinfectada con agua caliente.
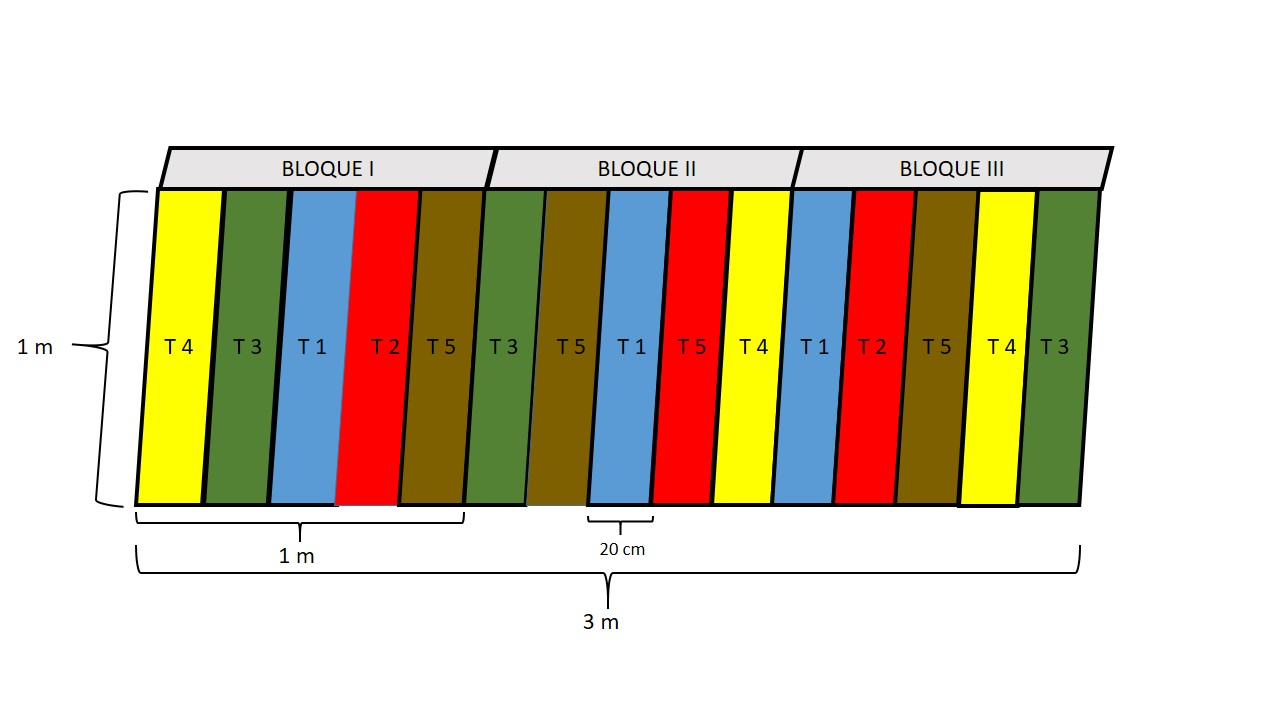
Figura 3.
Representación gráfica del diseño experimental utilizado.
Autores.
La fase 5 consistió en desarrollar actividades diarias de monitoreo y control (Figura 4). El monitoreo de la germinación se realizó todos los días a las 4:00 pm durante 30 días. Las variables evaluadas fueron germinación, supervivencia y vigor de semillas. Para cuantificar el porcentaje de germinación se aplicó la ecuación 1, y para el vigor de semillas la ecuación 2.
(1): PG = (SG/SS) * 100 donde PG (porcentaje de germinación), SG (semillas germinadas) y SS (semillas sembradas).
(2): VG = VM * GDM, donde VM es el valor máximo o pico que se presenta entre los valores de germinación y se obtienen dividiendo porcentaje acumulado de germinación y la cantidad de días que se tarda la germinación; y GDM es la germinación media diaria calculada como la razón entre el porcentaje final de germinación y el número de días trascurridos para llegar el porcentaje final. En síntesis, el vigor es un valor compuesto único que refleja en un solo valor los cambios en el pico de germinación, la germinación total y la velocidad de germinación de las semillas (Czabator, 1962).

Figura 4.
(A) Lote de semillas, (B) aplicación de tratamientos, (C) adecuación de vivero, (D) inicios de la germinación de semillas de O. pyramidale.
Autores
Una vez que se verificara que los datos cumplieran el supuesto de normalidad, se realizó un análisis de varianza (ANOVA) ajustado a un modelo de efectos mixtos a un nivel de confianza de 0.05. Este modelo explica las variaciones y efectos de una variable en el tiempo, y determina diferencias entre variables. Los tratamientos y bloques se codificaron como efectos fijos, donde los bloques fueron denominados como replicas quedando el modelo de la siguiente manera (porcentaje de germinación vs tratamientos, replicas). Adicionalmente, los datos del valor máximo o pico de germinación acumulada se trataron con un ANOVA de un factor para determinar diferencia entre tratamientos en función a la velocidad máxima de germinación. Los datos se reportan como media más desviación estándar. Para ambas pruebas se utilizó el paquete estadístico Minitad versión 19.1.
Germinación
La germinación de semillas de O. pyramidale en todos los tratamientos inició al cuarto día después de la siembra con algunas diferencias de semillas germinadas entre tratamiento con respecto al primer día de germinación. Por ejemplo, en los tratamientos T2 y T5 del bloque 1, al primer día de inicio germinaron 15 y 12 respectivamente, mientras que en el T1 del bloque 3 fueron 26 semillas. Por el contrario, en el T5 del bloque 2, la germinación inicio al quinto día, T3 bloque 3 al quinto día, y T4 bloque 3 al séptimo día. Adicionalmente, se observó germinación hasta los 30 días de observación.
El porcentaje de germinación media diaria por tratamiento fue mayor en el T1 (4,4%) y T2 (3,2%). Mientras que en el T3 (2,4%), T4 (1,7%) y T5 (2,7%). Finalmente, el mayor porcentaje de germinación general ocurrió en el tratamiento uno (T1) con 88 semillas (59%), seguido del tratamiento dos (T2) con 65 (43%), T3 42 (28%), T4 40 (27%) y T5 35 (35%) (Figura 5, Tabla 1).
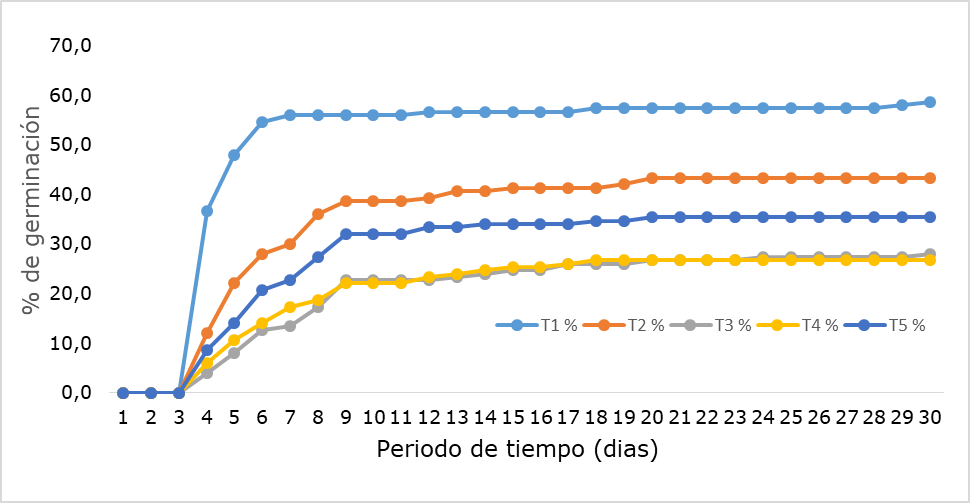
Figura 5.
Porcentaje de germinación acumulado.
Autores.
Comparación del porcentaje de germinación acumulado diario.
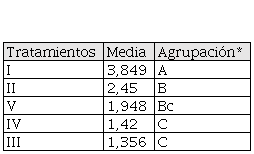
Autores. *Las medias que no comparte una letra son significativamente diferentes con P-Valor <0.05. Fuente: Autores.
En cuanto al tiempo medio de germinación (TMG) en el T4 y T3 las semillas alcanzaron la mayor velocidad y dispersión de germinación con 9 y 11 semillas respectivamente. En el resto de tratamientos se distribuyó de la siguiente manera: T1 (6 semillas), y T2 y T5 ambos con 7 semillas. El análisis de varianza (ANOVA) indica que no hubo diferencias estadísticamente significativas entre los tratamientos en función al porcentaje de germinación. Es decir, los resultados de la prueba permiten aceptar la hipótesis nula revelando que no existen efectos significativos de los tratamientos sobre la variable de respuestas (porcentaje de germinación de semillas de O. pyramidale) (Tabla 2). La desviación estándar estimada del error aleatorio según el modelo fue de 0,182 y R2 = 31,62%, lo cual indica que el modelo explica el 31,6% de las variaciones de la germinación en los tratamientos.
Resultados del análisis de varianza para la germinación de semillas de O. pyramidale entre tratamientos.
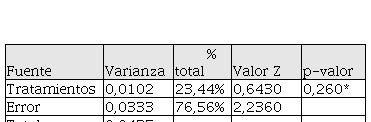
Autores. * p > 0.05.
Los valores de vigor germinativo de las semillas presentaron variaciones entre tratamientos. Los mayores valores en el T1 del bloque dos (55,5), seguido del T5 del bloque uno (33,4) (Tabla 3). Esto indica que, por medio del T1, las semillas de O. pyramidale alcanzan la mayor velocidad, o pico más alto para su germinación. Al mismo tiempo, el efecto es estadísticamente significativo con respecto a los demás tratamientos (Figura 6).
Vigor germinativo de semillas de O. pyramidale por tratamiento durante los 30 días de observación. VM (valor máximo o pico de germinación), GMD (germinación media diaria), VG (vigor de germinación).
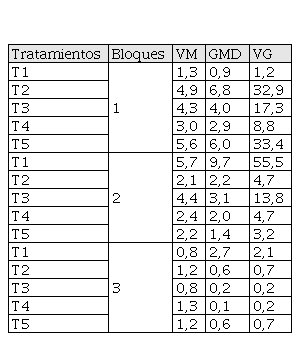
Autores.
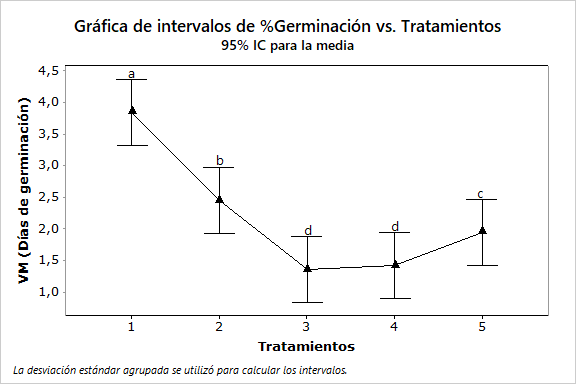
Figura 6.
Análisis germinativo en función al valor o pico máximo de germinación de semillas de O. pyramidale a los cuatro días. T1 (3,84 ± 2,62; P < 0,001), T2 (2,45 ± 1,29), T3 (1,35 ± 0,63), T4 (1,42 ± 0,68) y T5 (1,94 ± 0,98).
Autores
Los hallazgos de este ensayo demuestran que el método físico (agua caliente) ejerce mayor efecto en la germinación de las semillas de O. pyramidale. La germinación ocurrió al cuarto día después de la siembra en todos los tratamientos con algunas diferencias en cuanto al número de semillas germinadas entre tratamientos. Estos resultados son similares a los reportados por Camacho et al., (2018) quienes reportan la germinación en todos los tratamientos (sin alteración, semillas en remojo durante 6 horas e incisión) a los cuatro días después de la siembra. En contraste, difieren con Rojas-Rodríguez & Torres-Córdoba, (2009) y Ríos-García et al., (2016) quienes indica que la germinación ocurre a los ocho días posterior a la siembra.
El mayor porcentaje (59%) se observó en el T1 (agua 80°C). Lo cual coincide con lo reportado por Herrera & Alizaga, (1999) quien evalúa varios tratamientos (ácido giberélico 0, 100, 200 y 300mg/L, y nitrato de potasio 0,0,4, 0,8 y 1,2mg/L, agua a 80°C (0, 1, 2, y 3 minutos), y a 40°C (0, 24, 48 y 72 horas) obteniendo el 68% de germinación por medio de tratamientos por ebullición, siendo este el mayor porcentaje obtenido en comparación con el resto de tratamientos. Toledo-González et al., (2019) observan entre siete tratamientos, porcentajes entre el 62 y 69% en tratamientos que incluyeron agua caliente (100°C) con diferentes tiempos de exposición (tres y diez segundos) siendo los mayores porcentajes con diferencias estadísticamente significativas con respecto a los demás tratamientos evaluados. Por su parte, Rojas-Rodríguez & Torres-Córdoba, (2009) indican que aunque los porcentajes de germinación de O. pyramidale varíen entre 60 y 84%, pueden verse afectados por la calidad de la semilla.
Otras observaciones como las de Jiménez et al., (2017) informan que, a 80°C con exposición durante tres minutos, el porcentaje se ubica en un 8,76% y 19,14% cuando las semillas se exponen a 100°C por 15 segundos. Al contrario, Toledo-González et al., (2019) señalan que a 100°C tres segundo el porcentaje se ubica en un 64%. Adicionalmente, la impermeabilidad de la cubierta, factores intrínsecos como agua, gases, tipo de sustrato y luz también pueden tener influencia en las variaciones de germinación Figueroa & Jaksic, (2004); Rojas-Rodríguez & Torres-Córdoba, (2009) y Jiménez et al., (2017).
Por consiguiente, Herrera & Alizaga, (1999) y Toledo-González et al., (2019) confirman que los tratamientos por ebullición facilitan el rompimiento de la testa de la semilla como resultado del impacto de la temperatura, lo cual favorece positivamente la germinación. Adicionalmente, es posible que el enriquecimiento de sustrato con polvillo de coco combinado con agrolita 1:2, perlita y vermiculita 70:20:10 aumente la probabilidad de obtener altos porcentajes germinativos de semillas de O. pyramidale y de otras especies forestales debido al contenido de nutrientes y citocinas Ayala-Sierra & Valdez-Aguilar, (2008); Patiño et al., (2011); Ríos-García et al., (2016) y Toledo-González et al., (2019). Adicionalmente y aunque el tiempo y condición de almacenamiento no fueron objeto de estudio, Zalamea et al., (2015) señalan que el periodo y condiciones de almacenamiento pueden afectar de alguna manera la proporción de semillas de O. pyramidale. Por lo tanto, Espitia et al., (2016) sugieren que las condiciones y tiempo de almacenamiento pueden ser factores importantes en los procesos de germinación de semillas forestales (Cedrela odorata, Cariniana pyriformis, Anacardium excelsum, Bombacopsis quinata y Schizolobium parahybum). Por lo tanto, Ríos García et al., (2018) informan que, en especies como Cochlospermum vitifolium, y Quararibea funebris a cero meses de almacenamiento se logran porcentajes del 99,6% de germinación, mientras que a los 12 meses del 71,3%.
En definitiva, el efecto de los tratamientos por ebullición sobre la germinación de semillas forestales puede variar en función a las características naturales la especie. Por ejemplo, en semillas de algarrobo (Hymenaea courbaril L.), a 80°C y cinco minutos se muestra un porcentaje del 20%. Por contrario, con ácido clorhídrico HCl al 98% (cinco y diez minutos) y ácido sulfúrico H2SO4 98% (diez minutos) se logra hasta un 90% de germinación (Orozco-Cardona et al., 2010), guayacán (Guaiacum coulteri A.) con agua a 60°C diez minutos (51,1%)(Sánchez-Soto et al., 2017). En contraste, en el abarco (Cariniana pyriformis Miers) bajo inmersión en agua a temperatura ambiente durante 24 horas se obtiene un 29,1% (Pinilla et al., 2016).
El 59% de la germinación de semillas de O. pyramidale se obtuvo por medio del tratamiento por ebullición (agua 80°C) siendo el mayor porcentaje, en comparación con el resto de tratamiento. Los tratamientos por ebullición pueden ser la mejor elección para acelerar procesos germinación de semillas de O. pyramidale. Esto posiblemente se deba a la influencia de la temperatura en el rompimiento de la testa de la semilla. Además, este estudio demuestra que el efecto de los tratamientos por ebullición no solo contribuye al incremento de la germinación, sino que, además las semillas logran mayor velocidad germinativa, lo cual es una buena señal a la hora de tomar de decisiones rápidas relacionadas con procesos de recuperación ambiental.
CÓMO CITAR: Rios-Geovo, V., Córdoba-Tovar, L., Ramírez Mosquera, P. L., Copete
Arroyo, J. H., & Ramos Barón, P. A. (2020). Métodos de
escarificación química y sus efectos en la germinación de semillas de
Ochroma pyramidale Cav. ex Lam. Urb. Revista de Investigación Agraria y Ambiental, 12(1), 165 - 177. https://doi.org/10.22490/21456453.3727
CONTRIBUCIÓN DE LA AUTORÍA: Primer autor: metodología, investigación, conceptualización, análisis
de información, Segundo autor: análisis
de datos, escritura – revisión y edición. Tercer
autor: investigación, análisis de información. Cuarto autor: logística, supervisión y adquisición de recursos. Quinto autor: revisión,
conceptualización y escritura.
CONFLICTO DE INTERÉS: Los autores declaran no tener ningún conflicto de intereses.
https://hemeroteca.unad.edu.co/index.php/riaa/article/view/3727 (html)
https://hemeroteca.unad.edu.co/index.php/riaa/article/view/3727/4344 (pdf)
Los autores agradecen al grupo de investigación en Sistemas Productivos de la Universidad Tecnológica del Chocó y al grupo de investigación Institucionalidad y Desarrollo Rural de la Pontificia Universidad Javeriana, Bogotá. También agradecen a los revisores ya que sus comentarios y sugerencias contribuyeron a mejorar sustancialmente el manuscrito.

autores

Figura 1.
Ubicación geográfica del área de estudio.
Elaborado por el Geógrafo Juan Camilo Ospino Contreras.

Figura 2.
Metodología del ensayo. Las flechas en color azul indican los porcentajes de mayor a menor en función a los tratamientos aplicados.
Autores.

Figura 3.
Representación gráfica del diseño experimental utilizado.
Autores.

Figura 4.
(A) Lote de semillas, (B) aplicación de tratamientos, (C) adecuación de vivero, (D) inicios de la germinación de semillas de O. pyramidale.
Autores

Figura 5.
Porcentaje de germinación acumulado.
Autores.
Comparación del porcentaje de germinación acumulado diario.

Autores. *Las medias que no comparte una letra son significativamente diferentes con P-Valor <0.05. Fuente: Autores.
Resultados del análisis de varianza para la germinación de semillas de O. pyramidale entre tratamientos.

Autores. * p > 0.05.
Vigor germinativo de semillas de O. pyramidale por tratamiento durante los 30 días de observación. VM (valor máximo o pico de germinación), GMD (germinación media diaria), VG (vigor de germinación).

Autores.

Figura 6.
Análisis germinativo en función al valor o pico máximo de germinación de semillas de O. pyramidale a los cuatro días. T1 (3,84 ± 2,62; P < 0,001), T2 (2,45 ± 1,29), T3 (1,35 ± 0,63), T4 (1,42 ± 0,68) y T5 (1,94 ± 0,98).
Autores


