Introducción
La Guayata Oressochen melanopterus (o Chloephaga melanoptera), más conocida como Piuquén en la región sur de su distribución, es la única especie dentro del grupo de los gansos sudamericanos que realiza migraciones altitudinales. Este tipo de movimiento migratorio puede involucrar en algunos casos al total poblacional y en otros ser parcial o facultativo (Newton, 2008). Su distribución en época reproductiva abarca zonas andinas por encima de los 3000 m s. n. m. desde el centro de Perú (10° S), pasando por Bolivia, hasta los 35° S en Argentina y 36° S en Chile (Casares, 1934; Martínez Piña & González Cifuentes, 2017). En época no reproductiva, al menos en el área sur de su distribución, parte de su población se traslada a valles de menor altitud de alrededor de 2000 m s. n. m. o incluso menos (Castillón, 1918; Rodríguez Mata et al., 2006; Narosky & Yzurieta, 2010), como por ejemplo al valle de Calingasta (Fava et al., 2012).
Según Rose & Scott (1997), Delany & Scott (2006), Mundkur & Nagy (2012) y Carboneras & Kirwan (2018) el número poblacional total de la Guayata podría encontrarse entre 25.000 y 100.000 ejemplares, manteniéndose más o menos constante durante un lapso de tiempo importante de al menos dos décadas. Estas estimaciones, a pesar de no ser del todo precisas, parecerían indicar que su población se encuentra en buen estado de conservación, debido principalmente a la reducida modificación de sus ambientes reproductivos. Por ello, su estatus poblacional a nivel internacional se halla dentro de la categoría de preocupación menor (BirdLife International, 2016). Sin embargo, por causa de las persecuciones humanas observadas en los últimos años en sus áreas de invernada, en Argentina su estatus de conservación se ha establecido en la categoría de vulnerable (López-Lanús et al., 2008; MAyDS & AA, 2017).
El rol de las áreas de invernada en el ciclo anual de las aves acuáticas migratorias ha sido revalorizado desde hace algunos años (Baldassarre & Bolen, 1994). Estas zonas han demostrado, por ejemplo, ser claves para la conservación de migrantes altitudinales vulnerables o con poblaciones en declinación por causa de la pérdida de hábitat o la persecución humana (Powell & Bjork, 2001). Un buen campo de invernada proporciona a los migrantes suficientes recursos alimentarios para satisfacer sus necesidades fisiológicas durante ese período (Weller, 1999), como también para acumular reservas energéticas que les permitan emprender la migración primaveral y comenzar la etapa de cría con mejores probabilidades de éxito reproductivo (Trinder et al., 2009). Por último, les provee de sitios de descanso seguros, en muchos casos humedales que reducen la posibilidad de ser capturados por predadores, disminuyendo así la mortalidad (Evans, 1991).
Algunos de los ambientes invernales de la Guayata son valles intermontanos (Araya & Millie, 1991) en los que se practica agricultura intensiva bajo riego y ganadería de pequeña escala (Barros & Azócar, 2018). El hábitat reproductivo, por su parte, comprende bofedales de altura (Jaramillo, 2005), márgenes de lagos, lagunas, ríos y arroyos altoandinos (Johnson, 1965; Johnsgard, 2010). En estos tipos de ambientes construyen sus nidos entre pastos o rocas, mayormente cerca del agua, aunque a veces pueden hacerlo lejos de ella (de la Peña, 1992; de la Peña, 2015). Tanto en una como en otra localización su dieta ha sido muy poco estudiada, careciéndose casi por completo de datos. No obstante, se ha descrito que es casi completamente folívora y granívora, ingiriendo pastos, juncos y plantas acuáticas en las márgenes de los cuerpos de agua que frecuenta (del Hoyo et al., 1992; Kear, 2005; de la Peña, 2016).
En un contexto de escasez de información referida a importantes aspectos de la ecología de la Guayata, sobre todo en época no reproductiva, nuestra investigación tuvo por objetivo estimar el tamaño poblacional, describir el uso de los ambientes y la dieta de la especie en el área de invernada del valle de Calingasta. Finalmente discutimos la importancia de esta nueva información para la instrumentación de medidas de conservación para la Guayata en Argentina.
Materiales y métodos
Área de estudio
Este estudio se desarrolló en el valle de Calingasta (31°20’S y 69°25’O), localizado dentro del departamento del mismo nombre en la zona sudoeste de la provincia de San Juan, Argentina (Figura 1). El área comprende una serie de oasis artificiales producidos por el riego, enclavados en la provincia fitogeográfica del Monte, la cual ocupa la mayor parte de San Juan y forma en esta última provincia un amplio ecotono con la región de Prepuna, Puna y Altos Andes (Karlin et al., 2017). El clima es seco con escasas lluvias, predominando la vegetación arbustiva en suelos generalmente arenosos (Salvador, 2010).
El valle es una depresión de la superficie terrestre con el eje mayor orientado aproximadamente en dirección norte-sur y comprende una serie de localidades. Entre ellas se destaca la importancia de Calingasta, Sorocayense, Tamberías y Barreal, tanto por su mayor cantidad de habitantes como por la extensión de las áreas agrícolas que las rodean, las cuales comprenden una superficie de poco menos de 40 km2. Una gran proporción de los establecimientos agrícolas en el valle corresponden a pequeñas explotaciones familiares destinadas a forestaciones con salicáceas, frutales (como manzanos y nogales) y finalmente forrajeras y cultivos anuales o herbáceos (como aromáticas) (Van den Bosch, 2008).
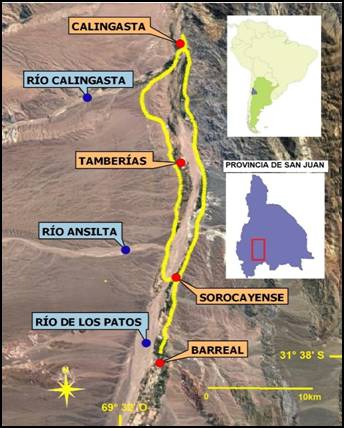 Figura 1.
Localización del valle de Calingasta (rectángulo
rojo en la provincia de San Juan) y principales poblados y accidentes
geográficos de la zona. La línea continua amarilla indica el recorrido
realizado
Figura 1.
Localización del valle de Calingasta (rectángulo
rojo en la provincia de San Juan) y principales poblados y accidentes
geográficos de la zona. La línea continua amarilla indica el recorrido
realizado
Aspectos
poblacionales
Las observaciones se realizaron en horas de la tarde los días 20 y 21 de julio de 2016, entre las 16:05 y 18:30 y entre las 12:00 y las 14:30, respectivamente. Para ello se recorrió el valle por la ruta nacional 149, la ruta provincial 406 y el empalme entre ambas (ruta provincial 412), totalizando poco más de 132 km (aproximadamente 66 km cada día). La estimación de la cantidad de individuos se efectuó utilizando el método de transecta (Bibby et al., 1992). Se empleó el método de conteo directo sucesivo, el cual realiza la enumeración directa de los individuos hasta que el último de los conteos difiriera en menos de un 10 % respecto del conteo previo. Los muestreos se efectuaron recorriendo el camino en vehículo equipado con GPS, a una velocidad de 40-50 km/h con detenciones al observar a la especie para su conteo. Las observaciones se realizaron con binoculares 7X42, telescopio 18-36X50 y las distancias se tomaron con un telémetro láser 6X21 con un alcance de 1000 m y una precisión de ± 1 m.
Las densidades y cantidades totales de ejemplares de Guayata se estimaron utilizando el programa Distance Sampling, versión 7.3 (Thomas et al., 2010). Este programa es utilizado frecuentemente para tratar datos obtenidos en conteos por transecta, modelándolos para ajustarlos a una función de probabilidad de detección que, en su forma más simple, asume que la detección disminuye con la distancia entre el objeto y la transecta, que todos los objetos a una distancia cero son detectados, que no se mueven hasta que se registra su posición y que, para nuestro caso, la distancia se toma al centro del grupo (pareja o bandada) (Buckland et al., 2015). El modelo que mejor se ajustó a la distribución de las distancias perpendiculares obtenidas se eligió bajo el criterio de información de Akaike (AIC), donde los menores valores del Akaike indican el modelo más verosímil (Burnham & Anderson, 2002).
Uso del
hábitat
Para estudiar el hábitat utilizado por la Guayata se utilizaron tres categorías de acuerdo con el tipo de vegetación, fisonomía y arquitectura de la misma. Ellas fueron: 1) Arbustos y árboles: campo o lote con presencia mayoritaria de árboles o arbustos (por lo general de varios metros de altura), 2) Campo natural: campo o lote que, habiendo sido cultivado en alguna oportunidad, no evidencia signos de laboreo reciente. Presenta algún tipo de vegetación implantada y a simple vista puede observarse una vegetación heterogénea y con alturas diversas, 3) Pasturas y otros cultivos (mayormente verduras y hortalizas): campo o lote con presencia mayoritaria de pastos (habitualmente de pocos centímetros de altura). El tipo de vegetación, la altura y la pertenencia de cada ambiente a alguna de las categorías citadas se determinó visualmente.
Además de clasificar el hábitat según las categorías antes indicadas, en cada oportunidad que se avistaron Guayatas, se categorizó en escala nominal la altura de la vegetación (alta ≥ 20 cm, baja ≤ 20 cm), como también la presencia de ganado en el potrero y la existencia de agua a distancias menores a 200 m. A efectos comparativos, en un recorrido completo del valle se efectuaron muestreos sistemáticos a intervalos regulares de 2 km observando hacia el lado del camino que daba al valle, hasta una distancia de 1000 m. En estos últimos muestreos se colectaron los mismos datos del hábitat que los registrados en potreros con presencia de Guayatas.
Dieta
Durante la mañana del 22 de julio, se colectaron 35 heces y material vegetal de referencia en cuatro ambientes del valle seleccionados al azar de entre los que, en los dos días anteriores, se observaron Guayatas. Tanto las fecas como el material vegetal de referencia fueron secados, molidos y tratados según el método de Williams (1968). Por cada muestra se montó un preparado y se analizaron 20 campos microscópicos por preparado, llegando al nivel más específico posible utilizando catálogos (Pelliza–Sbriller & Moraga, 1993) y por comparación con la colección propia.
El bajo coeficiente de digestibilidad de la Guayata hace que esta metodología sea especialmente apta para determinar su dieta tal como sucede para la mayoría de los anátidos (Owen, 1975). La determinación de la dieta de herbívoros mediante fragmentos epidérmicos (cutículas) y no epidérmicos (Sepúlveda Palma et al., 2004) de los principales grupos de plantas es una técnica muy común en los estudios tróficos realizados en gansos (Alsos et al., 1998; Fox et al., 2009; Soininen et al., 2010), y es reconocida como un método de identificación seguro.
Todas las muestras se analizaron utilizando un microscopio Olympus modelo CKX41 con un aumento de 400X, dotado de una cámara fotográfica digital Olympus Evol E 330. Muestras de fecas secas se midieron con calibre Vernier (precisión= 0,1 mm) y se pesaron con una balanza digital de precisión Pesola (precisión= 0,01 g).
Análisis
estadísticos
Para el uso del hábitat, la cantidad de ambientes con presencia de aves en los que se registraron diferentes características (tipo de vegetación, cercanía al agua, al ganado y altura de la vegetación), con respecto a la cantidad de ambientes en los que se registraron las mismas características en el muestreo de todo el valle, fue testeada mediante la prueba G (Mc Donald, 2009; Sokal & Rohlf, 2012). Para realizar la prueba se agruparon las categorías arbustos y árboles y campo natural en un grupo denominado resto de la vegetación ya que no se observó presencia de Guayatas en esos ambientes. El análisis estadístico de la información se efectuó utilizando el programa InfoStat (V 2010) (Di Rienzo et al., 2010). En los casos en que se muestran estimaciones poblacionales, el primer valor entre paréntesis que las acompaña es el error estándar y el segundo el intervalo de confianza (IC).
Resultados
Estimación
poblacional: abundancia y características de las bandadas
Un total de 680 y 894 individuos fueron contabilizados para el área durante el 20 y 21 de julio, respectivamente. La mayor cantidad de bandadas se halló en los alrededores de Tamberías (71,4 %). El tamaño de las bandadas mostró que una alta proporción de las mismas estuvieron compuestas por dos ejemplares (35,7 %, n= 14).
El modelo que mejor ajustó a la distribución de las distancias perpendiculares registradas fue el Half normal con un AIC= 191,3. En un contexto de alta variabilidad en el tamaño de las bandadas observadas (rango= 2-390) (Figura 2), el ancho de la faja de detección fue de 601 m, la densidad de bandadas resultó de 0,23 (± 0,09) por km2 (IC 95 %= 0,08-0,68), la densidad de Guayatas alcanzó el valor de 98 (± 56) por km2 (IC 95 %= 10,9-872,4), en tanto que el total de Guayatas en el valle se estimó en 3500 (± 2000) ejemplares (IC 95 %= 390-31000).
 Figura 2.
Grupo de dos ejemplares (izquierda) y vista parcial de la bandada de 390
individuos de Guayata (derecha) en proximidades de Barreal y Tamberías,
respectivamente, en el valle de Calingasta
Figura 2.
Grupo de dos ejemplares (izquierda) y vista parcial de la bandada de 390
individuos de Guayata (derecha) en proximidades de Barreal y Tamberías,
respectivamente, en el valle de Calingasta
Utilización
del hábitat
Las aves no se
distribuyeron equitativamente a lo largo de los tres hábitats diferenciados en
el valle de Calingasta (Figura 3a), mostrándose asociadas en forma
significativa con ambientes que presentaron pasturas y otros cultivos
implantados respecto del resto (G= 37,5, GL= 1, p< 0,0001, n= 46).
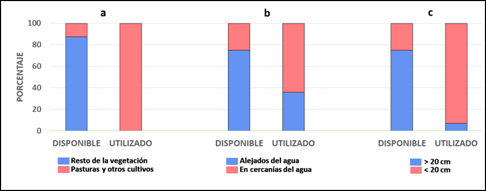 Figura 3.
Proporciones de ambientes disponibles y utilizados por la Guayata en el
valle de Calingasta, con indicación de sus diferentes características: a)
ambientes de cultivos de pastura, verduras u hortalizas, respecto del resto de
la vegetación, b) alejados o en cercanías del agua y c) de vegetación cuyas
alturas fueron mayores o menores que 20 cm
Figura 3.
Proporciones de ambientes disponibles y utilizados por la Guayata en el
valle de Calingasta, con indicación de sus diferentes características: a)
ambientes de cultivos de pastura, verduras u hortalizas, respecto del resto de
la vegetación, b) alejados o en cercanías del agua y c) de vegetación cuyas
alturas fueron mayores o menores que 20 cm
Además, se observó una asociación positiva y significativa con el agua (Figura 3b). La distribución observada de bandadas de Guayatas se asoció con el agua en mayor proporción que la esperada en relación con su disponibilidad (G= 6,4, GL=1, p= 0,012, n= 46).
Con relación al ganado, se observó que no existió asociación con los mismos (G= 0,01, GL= 1, p= 0,91, n= 46), en tanto que se registró una asociación significativa (G= 20,2, GL= 1, p< 0,0001, n= 46) con la vegetación de baja altura (Figura 3c).
Dieta
Las heces
colectadas fueron de forma cilíndrica, presentando en ocasiones en su extremo
más redondeado una mancha blanca producto del desecho de los riñones. Sus
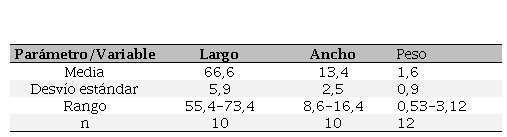
dimensiones y peso seco se muestran en la Tabla 1.
Tabla 1.
Dimensiones (mm) y peso (g) de una muestra de
heces de Guayata secas, colectadas en el valle de Calingasta durante el mes de
julio de 2016
|
Parámetro/Variable
|
Largo
|
Ancho
|
Peso
|
|
Media
|
66,6
|
13,4
|
1,6
|
|
Desvío estándar
|
5,9
|
2,5
|
0,9
|
|
Rango
|
55,4-73,4
|
8,6-16,4
|
0,53-3,12
|
|
n
|
10
|
10
|
12
|
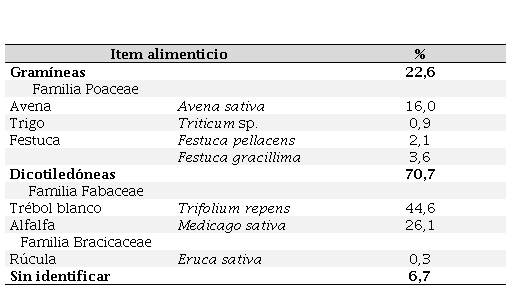
En la dieta detectamos exclusivamente material vegetal, identificándose tan sólo siete especies de plantas, pertenecientes a tres familias: Poaceae, Fabaceae y Brassicaceae (Tabla 2).
Agrupadas en dos grandes grupos, gramíneas y dicotiledóneas, se observó que las dicotiledóneas resultaron el principal grupo florístico consumido (70,7 %). Las especies más representadas resultaron ser dos leguminosas, el trébol blanco Trifolium repens (44,3 %) y la alfalfa Medicago sativa (26,1 %), seguidas por una gramínea, la avena Avena sativa (16,0 %). (Tabla 2).
Tabla 2.
Dieta de la Guayata en el valle de
Calingasta, durante la temporada invernal del año 2016, expresada como
frecuencia de ocurrencia relativa según análisis microhistológico (n= 35)
| Item
alimenticio |
%
|
| Gramíneas | |
22,6
|
|
Familia
Poaceae
| | |
|
Avena
|
Avena sativa
|
16,0
|
|
Trigo
|
Triticum sp.
|
0,9
|
|
Festuca
|
Festuca pellacens
|
2,1
|
|
Festuca gracillima
|
3,6
|
|
Dicotiledóneas
| |
70,7
|
|
Familia
Fabaceae
| | |
|
Trébol blanco
|
Trifolium repens
|
44,6
|
|
Alfalfa
|
Medicago sativa
|
26,1
|
|
Familia
Bracicaceae
| | |
|
Rúcula
|
Eruca sativa
|
0,3
|
|
Sin identificar
| | 6,7 |
Discusión
Este trabajo brinda la primera estimación poblacional de la Guayata para un área de invernada en general y para el valle de Calingasta en particular. Para el valle resulta de suma importancia, ya que el área podría estar manteniendo periódicamente una proporción altamente superior al 1 % de la población total de la especie. Por lo tanto, cumplimentaría uno de los criterios específicos (Grupo B de los criterios, Criterio 6) basados en aves acuáticas para que un área pueda ser declarada de importancia internacional para la conservación (Secretaría de la Convención Ramsar, 2013). La presencia y abundancia relativa de la Guayata del valle de Calingasta había sido establecida con anterioridad a nuestras observaciones, inclusive aportando información reciente (Fava et al., 2012; Lucero & Schmidt, 2014). Los antecedentes indicados señalan que la Guayata se observó en ambientes de cultivos próximos a Tamberías durante la época no reproductiva, en coincidencia con gran parte de nuestros registros.
Nuestro estudio
se llevó a cabo en el mes de julio, un mes clave junto con el de junio, dentro
del período no reproductivo para los gansos migratorios sudamericanos. En áreas
de invernada estudiadas durante más de un año a lo largo de todo el período
invernal, como en el valle inferior del río Chubut (en adelante, VIRCH) (Punta,
2019) y en el valle 16 de Octubre (Punta, G., datos no publicados), especies
migratorias estrechamente emparentadas con la Guayata como C. picta y C.
poliocephala(Bulgarella et al., 2014), mostraron siempre el máximo
de ejemplares en alguno de esos meses. De esta forma, los valores aportados por
los conteos de Guayata efectuados pueden servir como referencia para vigilar la
tendencia de la población que pasa la invernada en el valle de Calingasta y en consecuencia
para tomar medidas de conservación ante posibles eventualidades.
La gran variabilidad en la cantidad de ejemplares por bandada ya fue reportada para relevamientos de Guayatas en el Lago Junín, Perú, durante la época invernal (Summers & Castro, 1988). Allí, al igual que en nuestro trabajo, la proporción de bandadas compuestas por dos ejemplares fue alta (27 %). Además, tanto en el Lago Junín como en la Laguna de los Pozuelos (Jujuy, Argentina), se observaron Guayatas en grandes bandadas de varios cientos de ejemplares (hasta superando las 1000 aves) (Kear, 2005), del mismo modo que lo observado en el valle de Calingasta.
El uso del hábitat por parte de la Guayata reveló estrechas similitudes con lo registrado para los cauquenes Común y Real en varias de sus áreas de invernada, utilizando ambientes cultivados con algún tipo de pastura de baja altura (< 20 cm), al igual que lo registrado en los valles de Sarmiento (Punta et al., 2017a), 16 de Octubre (Punta et al., 2017b) y VIRCH (Punta, 2019). Los ambientes de pastos bajos (1 a 4 cm) fueron también los más utilizados para alimentarse por la Guayata en los alrededores del Lago Junín (Summers & Castro, 1988).
La existencia de agua en abundancia parece jugar también un rol clave para la Guayata en el valle de Calingasta. Además de ser utilizada para el riego de la vegetación de los ambientes cultivados en los que se alimenta, resulta de importancia porque las bandadas observadas se hallaron asociadas a zonas próximas al agua al igual que en el VIRCH (Punta, 2019) y porque ofrece variados lugares protegidos para el descanso nocturno de los grupos de aves. Una situación similar a esta última se ha observado para todas las restantes especies de gansos migratorios sudamericanos en el área de invernada de la provincia de Buenos Aires, donde juega también un papel central en sus áreas de reposo y alimentación (Petracci et al., 2008; Pedrana et al., 2018).
Por otro lado, y contrariamente a lo registrado para el Cauquén Común en el VIRCH (Punta, 2019), la Guayata en el valle de Calingasta se diferenció en que no se halló significativamente asociada con el ganado. En este valle la Guayata se observó en tan solo una ocasión en cercanías, pero no entremezclada, con el ganado vacuno, al igual que lo comunicado por Dourojeanni et al. (1968) para los alrededores del Lago Junín.
La dieta de la Guayata ha sido escasamente estudiada, contándose tan solo con registros que describen cualitativamente el tipo de vegetación sobre la cual se la observaba comiendo (Summers, 2005). El presente trabajo aporta el primer estudio para el valle de Calingasta y resulta ser también el primero diseñado para investigar cuantitativamente la dieta de la Guayata. Se observó que la misma fue exclusivamente herbívora, al igual que lo informado para la Guayata en el Lago Junín (Dourojeanni et al., 1968) y para otros gansos migratorios sudamericanos en sus áreas de invernada tales como C. picta en el VIRCH (Punta, 2019) y C. poliocephala en el valle 16 de Octubre (Sayegh, 2016).
La composición botánica de su dieta alcanzó una cantidad de especies ingeridas relativamente baja, no obstante, un escaso número de ítems alimentarios fue determinado también para C. picta en el área de invernada de Buenos Aires (Punta, G., datos no publicados). En ambas locaciones su dieta estuvo compuesta por unas pocas especies cultivadas en altas densidades y especialmente nutritivas (Semple, 1974). Coincidentemente en ambos casos los dos ítems preferentemente ingeridos, ricos en proteínas, representaron más del 70 % de su dieta. El trébol blanco y la alfalfa para O.melanopterus (70,4 %) y el trigo y el raigrás para C.picta (88,1 %).
Los principales ítems florísticos consumidos por la Guayata resultaron ser de gran importancia para la agricultura local como forraje ganadero. Este hecho se ha observado también para C. picta, la especie numéricamente más importante de las restantes pertenecientes a los gansos migratorios sudamericanos con las cuales se halla emparentada la Guayata, en casi todas las áreas de invernada donde se practica la agricultura intensiva (Muñoz, 2015). Tal esquema de aprovechamiento de los recursos alimentarios no es raro, y por el contrario es la regla general, a nivel mundial, en los gansos migratorios en el presente. Incluso muchas especies han abandonado antiguos sitios de invernada para frecuentar ahora cultivos agrícolas con superior contenido nutritivo y energético que las pasturas naturales (Fox et al., 2005).
Los agricultores del valle de Calingasta, a quienes consultamos cuando tomamos muestras para analizar la dieta, mostraron gran preocupación por la utilización por parte de la Guayata de algunas de sus parcelas cultivadas, y sobre todo por el posible consumo de una porción de sus sembradíos. Cabe señalar que la alimentación de la Guayata en esos ambientes no es necesariamente perjudicial para los cultivos, como se ha mostrado para áreas de invernada de otros gansos sudamericanos en Argentina (Petracci et al., 2016; Gorosábel et al., 2019). No obstante, debería prestarse atención a la situación, dado que aparentemente la población de Guayata que pasa la invernada en la parte sur de su distribución, pero en Chile, ha mostrado una contracción en el área ocupada (Barros & Azócar, 2018). La misma obedecería a la pérdida de hábitat natural, como consecuencia del desarrollo agrícola, ganadero, forestal y urbano, y a la persecución humana (Martínez Piña & González Cifuentes, 2017).
La agricultura moderna tiende a crear monocultivos de especies de gramíneas y dicotiledóneas altamente productivas las cuales son muy palatables para los gansos. Según Newton (2017) todos los gansos británicos se alimentan actualmente en campos de cultivo durante la invernada. En esos ambientes consumen cereales, y se alimentan de especies nutritivas fertilizadas en lugar de pasturas silvestres no fertilizadas. Como resultado de estos patrones, las tasas de ingesta son mucho mayores comparadas con las observadas en pasturas naturales, las que además poseen mayor contenido en fibra disminuyendo su digestibilidad (Fox & Abraham, 2017). Este escenario de aumento de la interacción entre gansos y cultivos parece estar ocurriendo en el valle de Calingasta donde la gran mayoría de las Guayatas se halló alimentándose en las áreas de cultivos más intensivos.
Conclusiones
El presente
trabajo aporta conteos de O. melanopterus en el valle de Calingasta
durante la invernada, como también una estimación del total poblacional para el
área. Esta información podrá ser utilizada como línea de base para la
conservación de una especie vulnerable en Argentina. Además, describe por
primera vez la dieta de la especie en un área de invernada. Por otro lado,
señala las asociaciones entre el hábitat que utiliza y los ambientes donde se
llevan adelante los cultivos en el valle, como también la superposición entre
su dieta y algunas de las especies cultivadas más intensivamente. La
información recabada puede ser de utilidad para justificar la instrumentación
en el área del valle de Calingasta de algún grado de protección temporal para
ayudar a la conservación de la Guayata.
Agradecimientos
GP agradece a
Miguel Fernández quien nos asistió en las tareas de campo y a Milton Menese,
quien colaboró con nosotros en Calingasta. Dedica este trabajo a la memoria de
Lorenzo Soriano y Raúl González. ND agradece a su familia como también a la
familia de GP por el apoyo y colaboración constante en su labor. Todos los
autores agradecen a Sandra Feijóo por la colaboración brindada para la
identificación del material vegetal colectado y a José Saravia por su
asistencia en la materia de su especialidad, la estadística. Asimismo,
agradecen a dos revisores anónimos y al editor, Edgardo Ortíz-Jaureguizar,
quienes con sus observaciones y sugerencias mejoraron sustancialmente el
trabajo. Por último, agradecen a Víctor Raimilla por sus acertados comentarios
y aportes que permitieron enriquecer la versión final del manuscrito.
Referencias
Alsos, I.G., Elvebakk, A. & Gabrielsen. G.W. (1998) ‘Vegetation exploitation by Barnacle Geese Branta leucopsis during incubation on Svalbard’, Polar Research, 17, pp. 1-14.
Araya, B. & Millie, G. (1991) Guía de campo de las aves de Chile, Santiago, Editorial Universitaria.
Baldassare, G.A. & Bolen. E.G. (1994) Waterfowl ecology and management, New York, Wiley & Sons.
Barros, R., & Azócar, I. (2018) ‘Piuquén Oressochen melanopterus’. En: Medrano, F., Barros, R., Norambuena, H. V., Matus, R. & Schmitt, F. (eds.) Atlas de las aves nidificantes de Chile, Santiago, Red de Observadores de Aves y Vida Silvestre de Chile, pp. 52-53 (en línea). Disponible en https://www.researchgate.net/publication/333295817_Atlas_de_las_Aves_Nidificantes_de_Chile/link/5e02872092851c83649921f5/download (Accedido 16 de setiembre 2020).
Bibby, C.J., Burgess, N.D. & Hill, D.A. (1992) Bird Census Techniques, London, Academic Press Ltd.
BirdLife International (2016) ‘Chloephaga melanoptera’. En: The IUCN Red List of Threatened Species 2016 (en línea). Disponible en e.T22679972A92836647. https://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22679972A92836647.en (Accedido 03 de abril 2020).
Buckland, S.T., Rexstad, E., Marques, T.A. & Oedekoven, C.S. (2015) Distance sampling: methods and applications. Methods in statistical ecology (en línea), Heidelberg, Springer. Disponible en https://doi.org/10.1007/978-3-319-19219-2 (Accedido 15 de marzo 2020).
Bulgarella, M., Kopuchian C., Di Giácomo, A.S., Matus, R., Blank, O., Wilson, R.E. & McCracken, K.G. (2014) ‘Molecular phylogeny of the South American sheldgeese with implications for conservation of Falkland Islands (Malvinas) and continental populations of the Ruddy-headed Goose Chloephaga rubidiceps and Upland Goose C. picta’, Bird Conservation International, 24, pp. 59-71.
Burnham, K.P. & Anderson, D.R. (2002) Model selection and multimodel inference: A practical information-theoretic approach, New York, Springer-Verlag.
Carboneras, C. & Kirwan, G.M. (2018) ‘Andean Goose (Chloephaga melanoptera)’. En: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.) Handbook of the Birds of the World Alive, Barcelona, Lynx Edicions (en línea). Disponible en https://www.hbw.com/node/52828 (Accedido 27 de julio 2018).
Casares, J. (1934) ‘Palmípedos argentinos’, Hornero, 5, pp. 289-306.
Castillón, L. (1918) ‘Hábitat de la «Avutarda» Chloephaga melanoptera Eyton’, Hornero, 1, pp. 108-110.
Delany, S. & Scott, D.A. (eds.) (2006) Waterbird Population Estimates, Fourth Edition, Wageningen, Wetlands International (en línea). Disponible en http://www.bio-nica.info/Biblioteca/Delany2006-1.pdf (Accedido 4 de enero 2016).
de la Peña, M.R. (1992) Guía de Aves Argentinas, Buenos Aires, LOLA.
de la Peña, M.R. (2015) Aves argentinas, incluye nidos y huevos, Buenos Aires, Eudeba.
de la Peña, M.R. (2016) ‘Aves argentinas: descripción, comportamiento, reproducción y distribución’, Comunicaciones del Museo Provincial de Ciencias Naturales Florentino Ameghino, no. 19, pp. 1-456.
del Hoyo, J., Elliott, A. & Sargatal, J. (eds.) (1992) Handbook of the birds of the World, Vol. 1, Barcelona, Lynx Edicions.
Di Rienzo J.A., Casanoves, F., Balzarini, M.G., González, L., Tablada, M. & Robledo, C.W. (2010) InfoStat versión 2010, Grupo InfoStat, FCA, Universidad Nacional de Córdoba. Disponible en http://www.infostat.com.ar (Accedido 27 de diciembre 2015).
Dourojeanni, M.J., Hofmann, R., García, R., Malleux, J. & Tovar, A. (1968) ‘Observaciones preliminares para el manejo de las aves acuáticas del Lago de Junín, Perú’, Revista Forestal del Perú, 2, pp. 3-52.
Evans, P.R. (1991) ‘Seasonal and annual patterns of mortality in migratory shorebirds: some conservation implications’. En: Perrins, C.M., Lebreton, J.-D. & Hirons, G.J.M. (eds.) Bird population studies: relevance to conservation and management, Oxford, Oxford University Press, pp. 346-359.
Fava, G.A., Acosta, J.C., Laspiur, J.A. & Moreno, M.V. (2012) ‘Avifauna del Valle de Calingasta y sus alrededores, provincia de San Juan, Argentina’, Acta Zoológica Lilloana, 56, pp. 66-81.
Fox, A.D., Madsen, J., Boyd, H., Kuijken, E., Norriss, D.W., Tombre, I.M. & Stroud, D.A. (2005) ‘Effects of agricultural change on abundance, fitness components and distribution of two arctic‐nesting goose populations’, Global Change Biol., 11, pp. 881-893.
Fox A.D., Eide, N.E., Bergesen, E. & Madsen, J. (2009) ‘Resource partitioning in sympatric Arctic-breeding geese: summer habitat use, spatial and dietary overlap of Barnacle and Pink-footed Geese in Svalbard’, Ibis, 151, pp. 122-133.
Fox, A.D. & Abraham, K.F. (2017) ‘Why geese benefit from the transition from natural vegetation to agriculture’, Ambio, 46, pp. 188-197.
Gorosábel, A., Pedrana, J., Bernad, L., Caballero, V.J., Muñoz, S.D., & Maceira, N.O. (2019) ‘Evaluating the impacts and benefits of sheldgeese on crop yields in the Pampas region of Argentina: a contribution for mitigating the conflicts with agriculture’, Agriculture, Ecosystems & Environment, 279, pp. 33-42.
Jaramillo, A. (2005) Aves de Chile, Barcelona, Ediciones Lynx.
Johnsgard, P.A. (2010) Ducks, Geese and Swans of the world. Revised edition, Lincoln, University of Nebraska Press.
Johnson, A.W. (1965) The birds of Chile and adjacent regions of Argentina, Bolivia and Perú. Vol. 1, Buenos Aires, Platt Establecimientos Gráficos.
Karlin, U.O., Karlin, M.S., Zapata, R.M., Coirini, R.O., Contreras, A.M. & Carnero, M. (2017) ‘La Provincia Fitogeográfica del Monte: límites territoriales y su representación’, Multequina, 26, pp. 63-75.
Kear, J. (2005) Ducks, geese and swans. Volume I: General chapters, and species accounts (Anhima to Salvadorina), Oxford, Oxford University Press.
López-Lanús, B., Grilli, P., Coconier, E., Di Giacomo, A., & Banchs, R. (2008) Categorización de las aves de la Argentina según su estado de conservación, Buenos Aires, Informe de Aves Argentinas/AOP y Secretaría de Ambiente y Desarrollo Sustentable.
Lucero, F. & Schmidt, C. (2014) ‘Observaciones de Macá Plateado (Podiceps occipitalis occipitalis) y Golondrina Zapadora (Riparia riparia) en la Laguna Seca, Guayata (Chloephaga melanoptera) y Cauquén Común (Chloephaga picta) en la Laguna Larga, provincias de San Juan y Mendoza, Argentina’, EcoRegistros, 4, pp. 21-28.
Martínez-Piña, D. & González-Cifuentes, G. (2017) Aves de Chile. Guía de Campo y Breve Historia Natural, Santiago, Ediciones del Naturalista.
MAyDS & AA. (2017) Categorización de las Aves de la Argentina (2015), Buenos Aires, Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas (en línea). Disponible en https://avesargentinas.org.ar/sites/default/files/Categorizacion-de-aves-de-la-Argentina.pdf (Accedido 3 de julio 2019).
Mc Donald, J.H. (2009) Handbook of Biological Statistics (en línea), Baltimore, Sparky House Publishing. Disponible en http://www.biostathandbook.com/HandbookBioStatSecond.pdf (Accedido 30 de agosto 2012).
Mundkur, T. & Nagy, S. (eds.) (2012) Waterbird Population Estimates, Fifth Edition, Wageningen, Wetlands International (en línea). Disponible en https://www.wetlands.org/wp-content/uploads/2015/11/Waterbird-Populations-Estimates-Fifth-Edition.pdf (Accedido 14 de mayo 2016).
Muñoz, M.V. (2015) Aspectos de la ecología poblacional y dieta del Cauquén Común Chloephaga picta en cuatro agroecosistemas localizados en las Provincias de Chubut y Río Negro y sus implicancias para el patrón migratorio y la gestión ambiental, Informe final de práctica profesional de la Licenciatura en Protección y Saneamiento Ambiental inédito, Trelew, Universidad Nacional de la Patagonia San Juan Bosco.
Narosky, T. & Yzurieta, D. (2010) Aves de Argentina y Uruguay. Guía de identificación. Edición total, Buenos Aires, Vázquez Mazzini.
Newton, I. (2008) The migration ecology of birds, London, Academic Press.
Newton, I. (2017) Farming and birds, London, Harper Collins.
Owen, M. (1975) ‘An assessment of fecal analysis technique in waterfowl feeding studies’, Journal of Wildlife Management, 39, pp. 271-279.
Pedrana J., Pütz, K., Bernad, L., Seco Pon, J.P., Gorosábel, A., Muñoz, S.D., Isacch, J.P., Matus, R., Blank, O, Lüthi, B., Lunardelli, M. & Rojas, P. (2018) ‘Migration routes and stopover sites of Upland Geese Chloephaga picta in South America’, Avian Biology Research, 11, pp. 89-99.
Pelliza–Sbriller, A. & Moraga, S.H. (1993) ‘Dibujos de tejidos epidérmicos de especies patagónicas. I. Gramíneas y graminoideas. II. Hierbas, arbustos y árboles (a-Gimnospermas, b-Dicotiledóneas)’ Bariloche, Comunicación Técnica INTA.
Petracci, P.F., Ibáñez, H., Scorolli, A., Cozzani, N., Blanco, D., de la Balze, V., Forcelli, D., Goldfeder, S., Mac Lean, D., Carrizo, M., Zamorano, M., Cereghetti, J., Sarriá R. & Veiga, J. (2008) Monitoreo poblacional de cauquenes migratorios (Chloephaga spp.) en las provincias de Buenos Aires y Río Negro: Una actualización sobre su estado crítico de conservación, Buenos Aires, Informe de la Secretaría de Ambiente y Desarrollo Sustentable de la Nación (en línea). Disponible en https://www.yumpu.com/es/document/read/34841647/monitoreo-poblacional-de-cauquenes-en-buenos-aires-y-ra-o-negro (Accedido 24 de agosto 2013).
Petracci, P., Zalba, S.M., Delhey, V.K. & Darrieu, C.A. (2016) ‘Efecto del pastoreo por el Cauquén común (Chloephaga picta) en cultivos de trigo (Triticum durum)’, Ornitología Neotropical, 27, pp. 169-180.
Powell, G.V.N. & Bjork, R. (2001) ‘Migraciones altitudinales e interconexión de hábitats en bosques tropicales’. En: Primack, R., Rozzi, R., Feinsinger, P., Dirzo, R. & Massardo, F. (eds.) Fundamentos de conservación biológica. Perspectivas latinoamericanas, México D.F., Fondo de Cultura Económica, pp. 465-466.
Punta, G. (2019) ‘Aspectos de la ecología poblacional, utilización del hábitat, ecología alimentaria, conectividad migratoria y conservación de los cauquenes en el Valle Inferior del Río Chubut’, Naturalia Patagónica, 13, pp. 1-177.
Rodríguez Mata, J., Erize F. & Rumboll, M. (2006) Aves de Sudamérica, No Passeriformes, Buenos Aires, Harper Collins.
Rose, P.M. & Scott.
D.A. (eds.) (1997)Waterfowl Population Estimates, Second Edition, Wetlands
International Publication No. 44, Wageningen, Wetlands International
Salvador, S. (2010) ‘Zonas ornitogeográficas’. En: Narosky, T. & Yzurieta, D. Aves de Argentina y Uruguay. Guía de identificación. Edición total, Buenos Aires, Vázquez Mazzini, pp. 388-393.
Sayegh, V.S. (2016) Utilización del hábitat, aspectos demográficos y de la dieta de los cauquenes migratorios (Chloephaga spp.) en el valle 16 de Octubre, Trevelin, Chubut, Argentina, Informe final de la Práctica Profesional para la carrera de Licenciatura en Protección y Saneamiento Ambiental inédito, Trelew, Universidad Nacional de la Patagonia San Juan Bosco.
Secretaría de la Convención de Ramsar (2013) Manual de la Convención de Ramsar: Guía a la Convención sobre los Humedales (Ramsar, Irán, 1971), 6a. edición, Gland, Secretaría de la Convención de Ramsar (en línea). Disponible en https://www.ramsar.org/sites/default/files/documents/library/manual6-2013-sp.pdf (Accedido 5 de marzo 2020).
Semple, A.T. (1974) Avances en pasturas cultivadas y naturales, Buenos Aires, Editorial Hemisferio Sur.
Sepúlveda Palma, L., Pelliza, A. & Manacorda, M. (2004) ‘La importancia de los tejidos no epidérmicos en el microanálisis de la dieta de herbívoros’, Ecología Austral, 14, pp. 31-38.
Soininen, E.M., Hübner, C.E. & Jónsdóttir, I.S. (2010) ‘Food selection by Barnacle Geese (Branta leucopsis) in an Arctic pre-breeding area’, Polar Research, 29, pp. 404-412.
Sokal, R.R. & Rohlf. F.J. (2012) Biometry. The principles and practice of statistics in biological research, New York., W. H. Freeman & Company.
Summers, R.W. & Castro, G. (1988) ‘Population size and feeding behaviour of Andean Geese at Lake Junin, Peru’, Wildfowl, 39, pp. 22-28.
Summers, R.W. (2005) ‘Andean Goose Chloephaga melanoptera’. En: Kear, J. (ed.) Ducks, geese and swans. Volume I: General chapters, and species accounts (Anhima to Salvadorina), Oxford, Oxford University Press, pp. 410-411.
Thomas, L., Buckland, S.T., Rexstad, E.A., Laake, J.L., Strindberg, S., Hedley, S.L., Bishop, J.R.B., Marques, T.A. & Burnham. K.P. (2010) ‘Distance software: design and analysis of distance sampling surveys for estimating population size’, Journal of Applied Ecology, 47, pp. 5-14.
Trinder, M.N., Hassell, D. & Votier, S. (2009) ‘Reproductive performance in arctic-nesting geese is influenced by environmental conditions during the wintering, breeding and migration seasons’, Oikos, 118, pp. 1093-1101.
Van den Bosch, M.E. (2008) Zonas agroeconómicas homogéneas. San Juan y Mendoza. Estudios económicos de los sistemas productivos y recursos naturales N° 4, Buenos Aires, INTA (en línea). Disponible en https://inta.gob.ar/documentos/zonas-agroeconomicas-homogeneas-san-juan-y-mendoza (Accedido 9 de abril 2020).
Weller, M.W. (1999) Wetland Birds: Habitat Resources and Conservation Implications, Cambridge, Cambridge University Press.
Williams, O.B. (1968) ‘An improved technique for the identification of plant fragments in herbivore feces’, Journal of Range Management, 22, pp. 51-62.
Punta, G., Laztra, E., Ricci,
M., Pérez Gallo, S., Feijóo, S. & Saravia, J. (2017a) ‘Seasonal demographic
patterns and habitat utilization of Chloephaga picta in the Sarmiento
Valley, Chubut’, Ornithological Congress of the Americas – XVII RAO/XXIV
CBO/XCV AFO -, Puerto Iguazú, 8-11 de agosto, Association of Field
Ornithologists, Sociedade Brasileira de Ornitologia and Aves Argentinas, p.
236
Punta, G., Sayegh, V. &
Dalla Rosa, G. (2017b) ‘Estimación poblacional de cauquenes migratorios Chloephaga
spp. realizada en el Valle 16 de Octubre durante la invernada del año
2016’, V Congreso Nacional de Conservación de la Biodiversidad, Las
Grutas, 19-22 de setiembre, Ciudad Autónoma de Buenos Aires, Fundación de
Historia Natural Félix de Azara, p. 115









