Resumen: Los sedimentos estuarinos juegan un rol primordial en los procesos de remineralización de los nutrientes; entre ellos, el fósforo (P) que es un elemento esencial para la vida. En este trabajo, se evaluaron los niveles de P en sedimentos de la capa superficial (S: 0-5mm profundidad) y sub-superficial (SS: 5–10mm profundidad) de la planicie de marea supramareal baja de Puerto Rosales (zona media del estuario de Bahía Blanca, Argentina). A su vez, se presentan los primeros estudios de especiación de P. Se determinó la composición granulométrica, el porcentaje de humedad y de materia orgánica, pH, Eh y la temperatura en los sedimentos con el fin de evaluar su relación con las distintas fracciones de P analizadas. Los resultados mostraron altos niveles de P total (de hasta 1,055 mg P g-1 ps) y no hubo diferencias significativas entre capas, lo que refleja la capacidad de estos sedimentos para retener el P autóctono y/o antropogénico. En general, el P tendió a permanecer como P ligado a minerales fosfatados de Ca y/o como P-refractario o residual (40% y 35%, y 20% y 31% en S y SS, respectivamente). La composición granulométrica del sedimento estaría favoreciendo la retención del P, mientras que la inundación la estaría afectando sobre todo en la fracción correspondiente al P-lábil o adsorbido (11% y 23% para S y SS, respectivamente). La variabilidad observada en la proporción aportada por el P-Fe en ambas capas, parece estar relacionada con la disolución de los PO43- y su difusión hacia la columna de agua a través del agua intersticial.
Palabras clave: Especiación de Fósforo, Extracción Secuencial, Planicie de Marea, Puerto Rosales.
Abstract: Estuarine sediments play a key role in the processes of nutrient remineralization; among them, phosphorus (P) is an essential element for life. In this work, we evaluated the levels of P in sediments of the surface layer (S: 0-5mm depth) and sub-surface layer (SS: 5-10mm depth) of the low supratidal plain of Puerto Rosales (middle zone of the Bahía Blanca estuary, Argentina). This is also the first study of P speciation in this area. In order to assess the relationship among physico-chemical parameters and the different fractions of P analyzed, we determined granulometric composition, percentage of moisture and organic matter, pH, Eh and temperature in the sediments. The results showed high levels of total P (up to 1.055 mg P g-1 dw) and there were no significant differences between layers, reflecting the ability of these sediments to retain native and / or anthropogenic P. In general, P tended to remain as P linked to phosphate minerals of Ca and as refractory or residual P (40% and 35%, and 20% and 31% in S and SS, respectively). The granulometric composition of the sediment would favor the retention of P while the flood would be affecting it, especially in the fraction corresponding to the labile o adsorbed P (11% and 23% for S and SS, respectively). In both layers, the variability observed in the proportions of P-Fe and the moderately labile P seems to be related to the dissolution of PO43- and its diffusion towards the water column through porewater.
Keywords: Phosphorus Speciation, Sequential Extraction, Tidal Flat, Rosales Harbor.
Resumo: Os sedimentos estuarinos desempenham um papel fundamental nos processos de remineralização dos nutrientes; entre eles está o fósforo (P), que é um elemento essencial para a vida. Neste trabalho, foram avaliados os níveis de P em sedimentos da camada superficial (S: 0–5mm de profundidade) e subsuperficial (SS: 5–10mm de profundidade) da planície de maré supramaré baixa de Puerto Rosales (zona média do estuário de Bahía Blanca, Argentina). Por sua vez, são apresentados os primeiros estudos de especiação de P. Foram determinados a composição granulométrica, a porcentagem de umidade e de matéria orgânica, pH, Eh e a temperatura nos sedimentos para avaliar sua relação com as diferentes frações de P analisadas. Os resultados mostraram altos níveis de P total (de até 1,055 mg P g-1 ps) e não houve diferenças significativas entre as camadas, o que reflete a capacidade desses sedimentos em reter o P autóctone e/ou antropogênico. Em geral, o P tendeu a permanecer como P ligado a minerais fosfatados de Ca e/ou como P-refratário ou residual (40% e 35%, e 20% e 31% em S e SS, respectivamente). A composição granulométrica do sedimento favoreceria a retenção do P, enquanto a inundação a afetaria principalmente na fração correspondente ao P-lábil ou adsorvido (11% e 23% para S e SS, respectivamente). A variabilidade observada na proporção aportada pelo P-Fe nas duas camadas parece estar relacionada à dissolução dos PO43- e sua difusão à coluna d'água através da água intersticial.
Palavras-chave: Especiação de fósforo, Extração Sequencial, Planície de Maré, Puerto Rosales.
Dossier
Primer estudio sobre fraccionamiento de fósforo en sedimentos supramareales del estuario de Bahía Blanca (Argentina)
First study on phosphorus fractionation in supratidal sediments of the Bahia Blanca estuary (Argentina)
Primeiro estudo sobre fracionamento de fósforo em sedimentos de supramaré do estuário de Bahía Blanca (Argentina)
Recepción: 01 Diciembre 2019
Aprobación: 01 Mayo 2020
Publicación: 01 Agosto 2020
Actualmente, los estuarios exhiben una clara evidencia de eutrofización debido al aporte de nutrientes de origen antrópico (Nixon & Fulweiler, 2009; Spetter et al., 2015b; López Abbate et al., 2015) y juegan un rol primordial en donde los procesos biogeoquímicos modifican los flujos de nutrientes desde el continente hacia el mar (Lillebø et al., 2004, Van der Zee et al., 2007). En el ambiente acuático, el fósforo (P) disuelto es consumido durante el crecimiento del fitoplancton y luego es regenerado durante la descomposición de la materia orgánica (Sundby et al., 1992). Parte de esa regeneración tiene lugar en el agua pero en muchos ambientes poco profundos, tales como lagos y estuarios, los sedimentos juegan un importante rol en la regeneración del fosfato (Fisher et al., 1982). Estos sedimentos reciben una mezcla de P orgánico e inorgánico desde la columna de agua y el material en suspensión. Algunos de estos compuestos son inertes y quedan enterrados en el fondo y otros son descompuestos o disueltos y liberados hacia la columna de agua por medio del agua intersticial proporcionando P biodisponible bajo la forma de PO43- (Sundby et al., 1992; Paytan & McLaughlin, 2007).
Si bien el P es considerado un nutriente limitante para el crecimiento del fitoplancton en algunos ambientes marinos y estuariales, el uso de pesticidas y fertilizantes en la agricultura y el vertido continuo de aguas residuales urbanas e industriales, que terminan en el mar o bien vertidos directos sobre las zonas marinas costeras y estuariales del mundo, están añadiendo grandes cantidades de P que se está acumulando más rápidamente que el N (entre otros elementos) (Paytan & McLaughlin, 2007). La disponibilidad del P en ambientes marinos influye en el ciclo del carbono y en el secuestro del CO2 atmosférico. A pesar de la importancia del ciclo del P en este tipo de ambientes, el conocimiento respecto a la estructura química de sus formas orgánica e inorgánica en el sedimento es aún limitado debido a la baja abundancia natural del P y a las dificultades analíticas para aislar las diferentes formas de P en los sedimentos (Williams et al., 1967; Maher & Woo, 1998; Worsfold et al., 2005; Defforey & Paytan, 2018).
El estuario de Bahía Blanca (EBB) es considerado un sistema naturalmente eutrófico debido a su alto contenido de macronutrientes disueltos (Freije & Marcovecchio, 2004; Spetter et al., 2015b) y altamente productivo con altos niveles de materia orgánica (Spetter et al., 2015b) y un importante acoplamiento bentónico-pelágico (Guinder et al., 2017). El estuario posee una morfología compleja compuestas por islas, extensas planicies de marea y canales, influenciado por un régimen de marea semidiurno (Piccolo et al., 2008). En el veril Norte de su Canal Principal se encuentran los núcleos urbanos de Bahía Blanca, Gral. Cerri, Ing. White y Punta Alta, y algunos de los principales puertos de la Argentina: Puerto Galván e Ing. White y la Base Naval de Puerto Belgrano. Bordeando el área portuaria se desarrolla uno de los polos petroquímicos más grandes del país que se compone principalmente de refinerías, industrias petroquímicas y de obtención de fertilizantes (urea y amoníaco), así como también, fábricas de plásticos, molinos cerealeros, silos, malterías y frigoríficos. La zona media del estuario se caracteriza por poseer una extensa planicie de marea (1000m) donde el área supramareal es inundada en condiciones de tormenta o mareas de sicigia (Cuadrado et al., 2011). En esta zona del estuario, la descarga de líquidos cloacales ha sido reconocida como una de las principales fuentes de contaminación biológica y química (Spetter et al., 2015a). Estudios realizados por Fernández et al. (2016) sobre los primeros milímetros de los sedimentos ubicados en el supramareal bajo de esta zona de estudio han demostrado que la producción microfitobentónica es máxima durante la estación fría. De este modo, teniendo en cuenta la importancia del P como uno de los macronutrientes limitantes para la producción primaria en este tipo de ambientes, que los estudios referidos a la identificación de las distintas formas de P en el EBB son escasos y que en el caso de la zona media son inexistentes; el objetivo de este trabajo fue determinar la especiación y distribución del P en los sedimentos superficiales y sub-superficiales de la planicie de marea supramareal baja de Puerto Rosales (zona media del EBB) durante la época invernal y evaluar su distribución en función de las variables físico-químicas e hidrológicas del sistema.
El estuario de Bahía Blanca está situado en el sudoeste de la Provincia de Buenos Aires, Argentina (38°45’- 39°25’ S y 61°45’ – 62°30’ O) (Fig. 1). Es un sistema marino costero templado, altamente turbio, del tipo mesomareal (Hayes, 1979; Piccolo et al., 2008); se lo considera moderadamente eutrófico, en función de los niveles de macronutrientes disueltos y clorofila (IADO, 2018). El clima seco y templado es característico de esta región con una temperatura ambiente media anual de 15,6 °C y una precipitación media anual de 460,55 mm. La dirección del viento es predominantemente NNO, NO y N, con una velocidad media de 22,6 km/h (Píccolo & Diez, 2004). La amplitud media de la marea en los puertos de Ing. White y Galván (zona más interna) es de 3,8 y 2,7 m en sicigia y cuadratura, respectivamente (Perillo & Piccolo, 1991). Sus márgenes incluyen grandes planicies de marea de composición principalmente limo-arcillosa y parcialmente vegetadas por halófitas (Perillo & Piccolo, 1991; Botté, 2005). En el veril norte del Canal Principal del EBB se encuentran ubicados varios puertos, ciudades (>350000 hab) e industrias (molinos cerealeros, depósitos de combustibles e industrias químicas y petroquímicas). El uso del suelo de esta región está además asociado con una intensa actividad agrícola-ganadera. Consecuentemente, la zona interna del estuario recibe el aporte de agua dulce principalmente, del río Sauce Chico (que drena un área de 1600 km2) y del arroyo Napostá Grande (que drena un área de 1240 km2) que descargan en la cabecera del mismo con una media anual de 1,9 y 0,8 m3/s, respectivamente (Piccolo et al., 2008). Sin embrago, el gran aporte de nutrientes y contaminantes proveniente de agua dulce deriva de la descarga cloacal de la ciudad de Bahía Blanca y Punta Alta, principalmente, donde se ha detectado “contaminación biológica” (Spetter et al., 2015a), y de la localidad de Ingeniero White (Piccolo et al., 2008; IADO 2018 y referencias allí citadas).
El presente estudio fue llevado a cabo en la planicie de marea de Puerto Rosales (38°55’S y 62°03’O) (Fig. 1), zona media del estuario de Bahía Blanca, que es un sistema depositacional silicoclástico con una gran planicie de marea con una pendiente muy suave compuesta de sedimentos finos que van desde arenosos a limo-arcillosos. Esta planicie experimenta grandes fluctuaciones en cuanto al contenido de agua, la salinidad y la temperatura, generando condiciones “extremas” restringiendo el tipo de organismos capaces de habitar allí haciéndolo sólo aquellos que pueden adaptarse. La zona supramareal baja y alta está colonizada por comunidades bentónicas que forman matas microbianas y producen sustancias poliméricas extracelulares (Extracellular Polymeric Substances, EPS) (Cuadrado et al., 2011; Pan et al., 2013; Fernández et al., 2016). La concentración de clorofila a y carbohidratos en estas zonas muestran un comportamiento estacional y una diferenciación espacial, en donde el tamaño de grano y el contenido de humedad contribuyen a aumentar la producción de carbohidratos (Fernández et al., 2016). Spartina alteniflora coloniza la zona intermareal y atenúa parcialmente la energía hidrodinámica que alcanza la zona supramareal, donde hay pequeños parches de Sarcocornia perennis. La zona supramareal baja se inunda por efecto de la marea aproximadamente cada 15 días; mientras que, la zona alta lo hace eventualmente, en condiciones de sicigia (dos veces al mes) o durante eventos de tormenta. Así, la vegetación protege el sitio de muestreo de la erosión y la depositación de sedimentos.
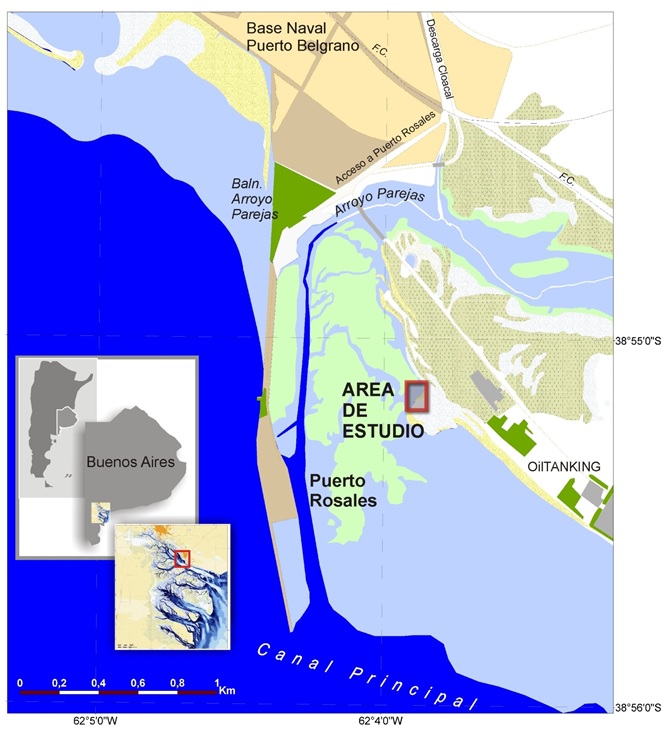
Figura 1.
Mapa indicando la ubicación del estuario de Bahía Blanca y el sitio de estudio, Puerto Rosales (Pcia. de Buenos Aires, Argentina)
Todo el material necesario para la determinación de fósforo, tanto el utilizado para la toma y el procesamiento de las muestras como el usado para realizar la determinación posterior, se acondicionó de la siguiente manera: se lo lavó con detergente no iónico al 1% (v/v) (libre de fosfatos) y agua de red, se lo enjuagó con HCl 10% (v/v), y luego con agua destilada; por último, se lo dejó secar (Gardolinski et al., 2001; Monbet & McKlelvie, 2007).
Para la determinación de las distintas formas de fósforo (P), durante el invierno de 2011 (10-Junio, 24-Junio, 6-Julio y 19-Julio), en un sitio de la zona supramareal baja sin vegetación (38º 55’ 17’’ S y 62º 03’ 42’’ O, Fig. 1) se colectaron, en bajamar, muestras de sedimentos mediante el uso de cuatro tubos de plexiglas tipo corers (3,5 cm. diam. y 15 cm. long.), extrayendo sedimentos hasta una profundidad de 5 cm aproximadamente (Adams, 1994). Del mismo modo, se tomaron muestras de sedimento por duplicado para la determinación del porcentaje de humedad (%H), de materia orgánica (%MO) y composición granulométrica de los sedimentos. Las muestras fueron trasladadas al laboratorio en dichos tubos corers cubiertos por bolsas individuales refrigeradas en una heladera portátil (4 ºC). Simultáneamente, se midieron in situ los parámetros físico-químicos (temperatura, pH y Eh) del sedimento superficial mediante el uso de un sensor HANNA Hi991003.
En el laboratorio, mediante el uso de un pistón, las muestras de sedimento fueron extraídas de cada tubo corer e inmediatamente fraccionadas, con espátulas de acero inoxidable acondicionadas, en dos capas: superficial (S: 0–5mm de profundidad) y sub-superficial (SS: 5–10mm de profundidad) de manera de diferenciar la capa que tuviese mayor contacto con el aire. Cada sub-muestra fue colocada en cajas de Petri individuales.
El %H fue calculado por diferencia de peso de la muestra antes y después del secado (60 ± 5°C, 4 días) (Christie et al., 2000). El %MO fue estimado por pérdida de peso por ignición de la muestra (450 ± 50 °C, 1h) (Dean, 1974; Buhl-Mortensen, 1996). La determinación del tamaño de grano de los sedimentos se realizó por difracción láser utilizando un analizador de partículas Malvern-Mastersizer-2000; para ello, la muestra fue tratada a priori con H2O2 100 vol (30%) para eliminar la materia orgánica.
Las muestras de sedimentos reservadas para la determinación de las distintas fracciones de fósforo fueron secadas a 60 °C durante 24 h, luego homogenizadas con un mortero de porcelana hasta un tamaño de partícula de unos 0,5 mm según la recomendación de Olsen & Dean (1965) y luego conservadas en bolsas de nylon y en desecador hasta su análisis.
Para la determinación de la concentración de fósforo total (PT) en sedimentos se realizó una digestión de la muestra en medio ácido (~0,5 g muestra, HNO3 conc./HClO4 60%, 200 °C) (Olsen & Sommers, 1982). Luego de la filtración de la muestra digerida, se llevó a un volumen de 100,0 mL con agua destilada y se le realizó la determinación automática de los iones orto-fosfatos (PO43-) por el método de azul de molibdeno (Eberlein & Kattner, 1987) mediante el uso de un autoanalizador Technicon II. Los resultados fueron expresados como mg P/g peso seco (mg P/g ps).
La extracción secuencial y especiación de fósforo inorgánico en los sedimentos se realizó según Lukkari et al. (2007) basada en la metodología tradicional de Chang & Jackson (1958). Las formas de fósforo (P) extraídas cuantificables fueron: (P1) P lábil o adsorbido, el cual representa la forma intercambiable iónicamente (extraído con NH4Cl 1M a pH 7, 2 h); (P2) P bajo la forma de fosfato de hierro, redox-sensible (extraído con NaCl 1M, 30 min., a 40°C y cuyo residuo fue tratado posteriormente con Na2S2O3 0,1 M a pH 7, 30 min., a 40°C); (P3) fósforo moderadamente lábil (extraído a temperatura ambiente con NaOH 1M, 16 h) que representa el P unido a la superficie de las arcillas o de los óxidos e hidróxidos de hierro (Fe) no reducibles y de aluminio (Al) y el P orgánico asociado a compuestos orgánicos tales como ácidos húmicos y fúlvicos; (P4) P orgánico ligado a minerales fosfatados de calcio (Ca) (P-apatita) (extraído con HCl 0,5 M, 24 h) y (P5) P refractario o residual (extraído con NaOH 1 M, 85°C, 24 h) (Fig. 2). La cuantificación de la concentración de P en las diferentes fracciones extraídas se realizó por determinación de los PO43- como se indicó anteriormente mediante el uso del autoanalizador Technicon II.
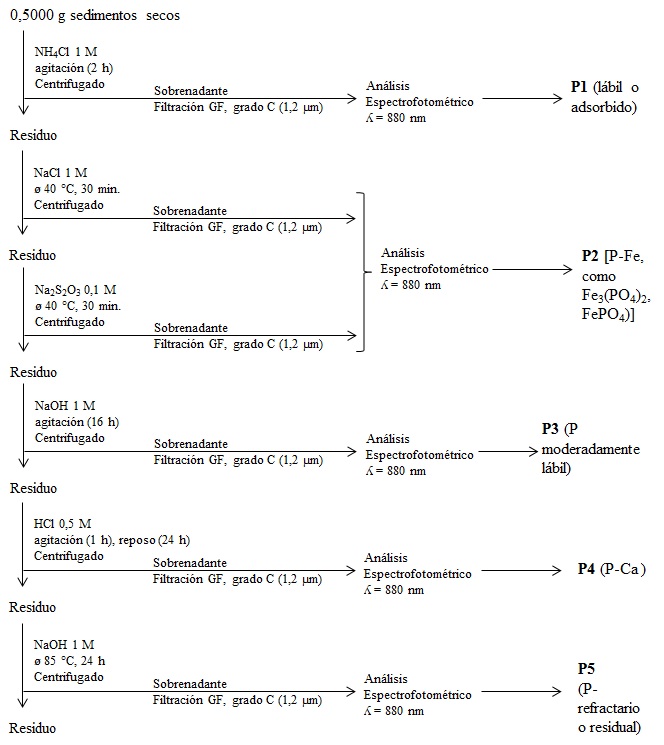
Figura 2.
Diagrama del método utilizado para la extracción y determinación de fósforo inorgánico en los sedimentos estuarinos
Se aplicó análisis de la varianza (ANOVA) simple para evaluar las diferencias entre las fechas de muestreo combinando los datos de ambas fracciones de sedimento, seguido del test LSD de Fisher (Least Significant Difference). Cuando los supuestos no se cumplieron, se aplicó Kruskal-Wallis. Por otro lado, para analizar las diferencias entre la capa superficial y subsuperficial se empleó el test t-Student para muestras apareadas. Los supuestos de homocedasticidad y normalidad fueron evaluados gráficamente mediante el uso de Q-Q plots y diagramas de residuos vs predichos. Los datos fueron tratados estadísticamente con el programa InfoStat® (versión 2016), siguiendo Zar (1996). Para ambos casos se trabajó con un nivel de significación de 0,05.
La temperatura del sedimento superficial durante la época invernal varió entre 2,1 y 10,7 °C, con una media de 7,1 °C (n = 4). Ésta, siguió la misma tendencia que la temperatura ambiente mínima registrada para la zona de estudio durante los días de muestreo (Fig. 3, Tabla 1).
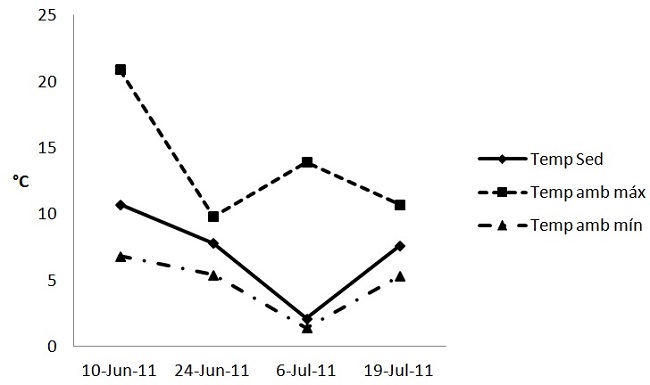
Figura 3.
Distribución de la temperatura del sedimento superficial y la temperatura ambiente en Puerto Rosales durante el invierno de 2011. Datos de temperatura ambiente máxima y mínima extraídos del Servicio Meteorológico Nacional publicados en el diario La Nueva Provincia
http://www.lanueva.com/clima/
Porcentaje de humedad (%H) y de materia orgánica (%MO) en la capa S (0-5 mm prof.) y SS (5-10 mm prof.), y valores de pH, Eh y temperatura (T) en los sedimentos superficiales de la planicie de marea supramareal de Puerto Rosales (zona media del estuario de Bahía Blanca)
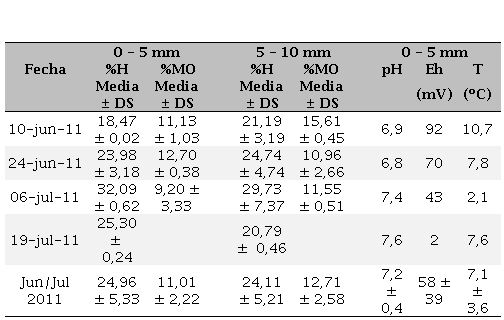
El %H en S se mantuvo entre un mínimo de 18,47 % (10-Jun-2011) y un máximo de 32,09 % (6-Jul-2011); mientras que, para el caso de la capa SS, se obtuvo un mínimo de 20,79 % y un máximo de 29,73 %, ambos en Julio de 2011 (Tabla 1). El promedio general del %H para todo el período estudiado (24,96 ± 5,33 %) mostró un mayor valor en la capa S que en la SS; tendencia esperada para la época del año debido a que la capa S es la que posee mayor contacto con el agua de mar en pleamar, cuando la planicie supramareal se llega a inundar. Por otro lado, la capa S estuvo compuesta por un mayor porcentaje de limo y arcilla (60 %, fracción fina) lo que permite una mayor retención del agua; mientras que la capa SS tuvo un mayor porcentaje de arena (70%) que de sedimentos finos (30%) (datos no graficados). El %H hallado en este estudio fue similar al hallado por Fernández et al. (2016) para el mismo sitio de muestreo, aunque mucho menor que el determinado por Spetter (2006) en bajamar en sedimentos del intermareal de la zona interna de dicho estuario.
En promedio, %MO fue mayor en la capa SS (12,71%) que en la S (11,01%) (Tabla 1). Si bien este porcentaje fue muy similar entre capas, para el caso de la S el rango se mantuvo entre 9,20% y 12,70%; mientras que para la capa SS fue de 10,96% a 15,61%. Estos valores fueron mayores a los detectados por Delucchi (2007) durante el período 2004 - 2006 en cinco estaciones de la zona interna del Canal Principal del estuario de Bahía Blanca y mayores a los detectados posteriormente por Fernández et al. (2016) para el mismo sitio de muestreo tanto en la capa S como en la SS. Ello puede deberse a la perturbación generada por el cangrejo cavador Neohelice granulata que fue colonizando este sitio de muestreo luego de la realización del presente estudio (Spetter et al. 2015a).
El rango de pH del sedimento superficial fue de 6,8 a 7,6, con un valor promedio de 7,2 (Tabla 1), valores típicos hallados en los sedimentos estuarinos (Caçador et al., 2004; Reddy & DeLaune, 2008). En tanto, los valores de Eh hallados para dichos sedimentos oscilaron entre 2 y 92 mV, obteniéndose un promedio de 58 mV (Tabla 1), lo cual estaría indicando condiciones reductoras de Fe(III). Los sedimentos limo-arcillosos de la capa S son impermeables permitiendo un flujo mínimo de O2 advectivo, lo cual estaría favoreciendo los procesos redox anaerobios, es decir que, la remineralización de la MO se estaría produciendo en condiciones anaerobias (Burdige, 2011). Valores de Eh entre 0 y 180 mV representan condiciones moderadamente anaeróbicas típicas para el caso de humedales y zonas de transición como en este caso (Redy & DeLaune, 2008), donde en sedimentos particularmente bioturbados y/o bioirrigados, la distribución de los procesos biogeoquímicos es mucho más compleja y se los considera sedimentos con una mezcla de condiciones redox (Burdige 2011). Además, éstas son características propias de las matas microbianas que se encuentran colonizando los sedimentos de la planicie (Cuadrado et al., 2011; Spetter et al., 2015a). Por otro lado, estudios realizados en mesocosmos demostraron que la oxidación/reducción del Fe en sedimentos marino costeros es altamente dependiente del contenido de carbono orgánico total (Laufer et al., 2016).
La concentración de PT en los sedimentos superficiales se mantuvo prácticamente constante durante el mes de junio (0,654 ± 0,097 mg P/g ps y 0,671 ± 0,099 mg P/g ps, el 10 y 24 de Junio de 2011, respectivamente) presentando un marcado incremento a principios del mes de julio (1,009 ± 0,039 mg P/g ps); mientras que, sobre finales de este mes, se observaron los menores valores registrados para todo el período evaluado (0,547 ± 0,056 mg P/g ps) (Fig. 4). Teniendo en cuenta ambas capas, S y SS, se encontraron diferencias significativas entre fechas (p = 0,0198) , siendo el 19 de Julio de 2011 la que difiere del 24 de Junio y 6 de Julio, mostrando un comportamiento diferencial en una misma estación del año sobre la concentración de PT en sedimentos (Fig. 4). Esto, probablemente es debido a que la producción microfitobentónica estaría consumiendo el P disponible disminuyendo su concentración en los sedimentos; de hecho, estudios realizados por Fernández et al. (2016) y Fernández (2017) para este mismo sitio de muestreo han mostrado durante el mes de Julio un aumento de la concentración de Clorofila a en los sedimentos, parámetro que se considera como un buen estimador de la producción microfitobentónica.
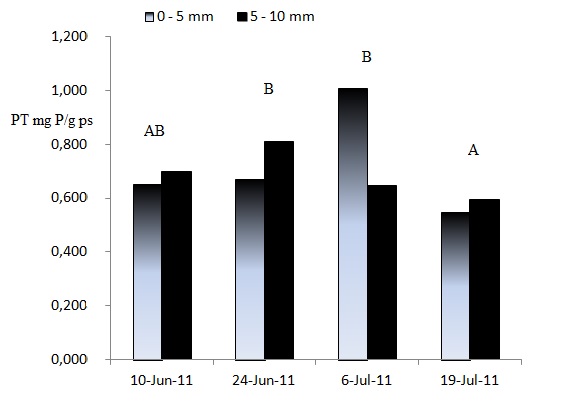
Figura 4.
Concentración media de fósforo total en sedimentos de la capas S y SS en la planicie de marea supramareal de Puerto Rosales, durante la época fría de 2011. Letras diferentes representan diferencias significativas (p < 0,05)
Considerando todo el período de muestreo, el rango de concentraciones medias de PT para la capa S, presentó un mínimo de 0,547 ± 0,056 mg P/g ps y un máximo de 1,009 ± 0,039 mg P/g ps; mientras que los sedimentos de la capa SS, mostraron concentraciones entre 0,595 ± 0,061 mg P/g ps y 0,809 ± 0,113 mg P/g ps. El análisis estadístico no mostró diferencias significativas entre capas.
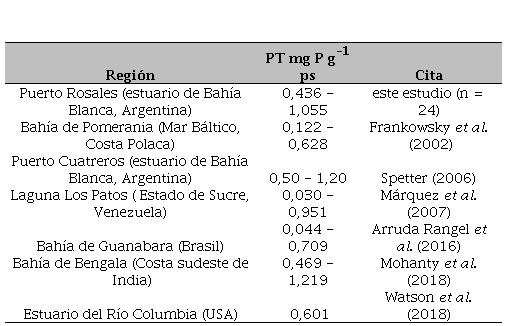
Si bien los estudios realizados sobre la dinámica del P en sedimentos estuarinos son escasos, sobre todo por la complejidad del procesamiento de las muestras, los resultados obtenidos en el presente estudio se han podido comparar tanto con estudios anteriores realizados en el país como en otros lugares del mundo. En los sedimentos de la zona interna del estuario de Bahía Blanca, en los humedales de Puerto Cuatreros, se han detectado concentraciones de PT similares a las halladas en este estudio (Tabla 2). Por otro lado, se observó que las concentraciones de PT encontradas en los sedimentos supramareales de Puerto Rosales, tanto en la capa S como en la SS, fueron mayores a las detectadas por Frankowski et al. (2002) en la Bahía de Pomerania (Mar Báltico), por Márquez et al. (2007) en la Laguna Los Patos (Venezuela) y por Arruda Rangel et al. (2016) en la Bahía de Guanabara (Brasil). Sin embargo, fueron similares a las encontradas por Mohanty et al. (2018) en la Bahía de Bengala (Costa Sudeste de India) y Watson et al. (2018) en el estuario del río Columbia (USA) (Tabla 2). Las altas concentraciones de PT que presentaron los sedimentos supramareales de Puerto Rosales, reflejan la capacidad de estos sedimentos para retener el P, tanto autóctono como el que proviene de diversas fuentes antrópicas. Cabe destacar, que en la planicie de marea donde se realizó el muestreo se reciben los desechos de la descarga de aguas cloacales de Punta Alta (~ 60000 hab) y que se han detectado concentraciones de P reactivo soluble (PRS) en agua intersticial de hasta 223,53 µM en este mismo sitio estudiado (Spetter et al. 2015a) y de hasta 3,16 µM en agua de columna del muelle de Puerto Rosales (Spetter, datos aun no publicados). Ello demuestra el aporte de PRS a partir de fuentes antrópicas.
Concentración de fósforo total (PT, mg P g-1 ps) en sedimentos de algunas áreas costeras en comparación con este estudio.
La concentración de P en los sedimentos superficiales (S) presentó un rango de concentraciones entre 0,008 y 0,540 mg P/g ps de P1; entre 0,068 y 0,971 mg P/g ps como P2; entre 0,053 y 0,970 mg P/g ps del P3; entre 0,441 y 1,848 mg P/g ps de P4 y entre 0,040 y 0,728 mg P/g ps del P5 (Tabla 3). Mientras que, en la capa SS este rango se mantuvo entre 0,142 y 0,583 mg P/g ps, 0,092 y 0,276 mg P/g ps, 0,030 y 0,083 mg P/g ps, 0,411 y 0,847 mg P/g ps y 0,051 y 0,769 mg P/g ps; respectivamente (Tabla 3). Los resultados obtenidos en este estudio para las fracciones P1, P2 y P4 fueron mayores a las concentraciones de fósforo halladas en sedimentos de fondo en la Bahía de Pomerania (0,001 – 0,009 mg P/g ph, 0,001 – 0,075 mg P/g ph y 0,054 – 0,367 mg P/g ph, respectivamente; Frankwoski et al. 2002). Teniendo en cuenta la capa S y los resultados de todas las extracciones realizadas para esta capa, la concentración de fósforo obtenida en las diferentes fracciones analizadas fueron mayores a las obtenidas por Arruda Rangel et al. (2016) en la Bahía de Guanabara (Brasil) (nd - 0,123 mg P/g, 0,009 – 0,264 mg P/g, 0,011 – 0,198 mg P/g, 0,003 – 0,138 mg P/g y 0,023 – 0,066 mg P/g para P1, P2, P3, P4 y P5, respectivamente). El tipo de sedimentos afecta al contenido de P (Frankowski et al. 2002); en el caso de la planicie de marea supramareal estudiada, los sedimentos de la capa S poseen un mayor porcentaje de la fracción fina la cual permite una mejor adsorción de P sobre las partículas, lo que podría originar una mayor retención de P en los sedimentos.
En la Figura 5 se presentan los porcentajes aportados de cada fracción de P a un total calculado a través de la sumatoria de todas las fracciones provenientes de las extracciones secuenciales. Del análisis de los resultados obtenidos de este modo en los sedimentos de la capa S y SS, se pudo observar que, en promedio, el aporte de P4 (P-Ca) fue predominante en ambas porciones del sedimento (40% y 35% en S y SS, respectivamente, Fig. 5) tal como se ha observado en la distribución de P en los sedimentos de la laguna Los Patos (Venezuela, Márquez et al. 2007), la Bahía de Bengala (India, Mohanty et al. 2018) y en el estuario del río Colombia (USA, Watson et al. 2018) . En los sedimentos estuarinos, esta fracción de P generalmente no varía su concentración en función de la profundidad (Yamada & Kayama, 1987). Dicha fracción es considerada “no reactiva” y se dificulta su disolución en condiciones ambientales normales. Sin embargo, a pH alcalino (pH ~ 8) algunas bacterias crecen con esta forma química como única fuente de P y éstas pueden alterar el pH de su alrededor promoviendo la liberación del PO43- estando nuevamente biodisponible (Halvorson et al. 1990, Arruda Rangel et al. 2016). Si bien el valor medio de pH en la capa superficial durante este estudio fue de 7,2, se han detectado valores de 7,6 (cercanos a 8) por lo que no se descarta que este proceso esté presente en la planicie de marea de Puerto Rosales. El segundo en prevalencia fue el P refractario o residual (P5) con un 23% en la capa S y un 31% en la SS; éste es característico de los sedimentos, siendo la fracción más estable dado que forma parte de la composición natural de las rocas y los sedimentos. El alto porcentaje de P refractario o residual estaría reflejando la capacidad de los sedimentos para entrampar el P en condiciones naturales tal como fue observado por Arruda Rangel et al. (2016) en sedimentos de la Bahía de Guanabara (Brasil).
Concentración de las distintas fracciones de fósforo (promedio ± desvío estándar, mínimos y máximos expresados en mg P/g ps) extraídas de los sedimentos de la planicie supramareal de Puerto Rosales durante la época fría de 2011
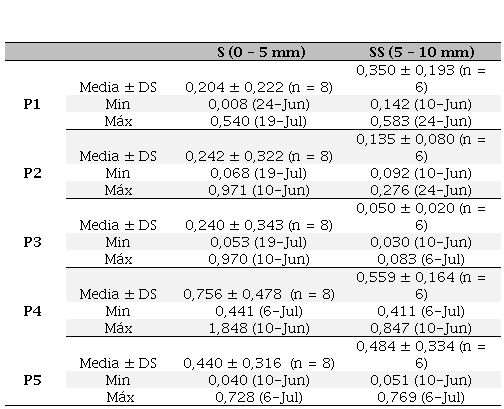
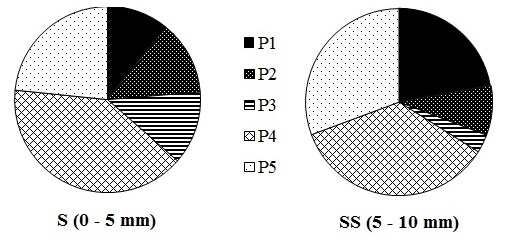
Figura 5.
Distribución porcentual de las distintas fracciones de fósforo extraídas del sedimento superficial y sub-superficial en la planicie de marea de Puerto Rosales durante el invierno de 2011
El P- lábil o adsorbido (P1), que se mantuvo entre un 11% y un 23% para la capa S y SS (Fig. 5), respectivamente, es considerada la especie de P más inestable. La diferencia en el porcentaje observado entre capas estaría relacionada con el mayor contacto con el agua para el caso de la capa S cuando se produce la inundación de la planicie. Así, el P adsorbido en la superficie de los sedimentos fácilmente puede ser disuelto y devuelto a la columna de agua, favorecido por cambios en los parámetros físico-químicos del agua, liberando PO43- que estaría nuevamente biodisponible para los productores primarios (Arruda Rangel et al. 2016). En coincidencia con esta premisa, Fernández et al. (2016) pudo corroborar que la producción microfitobentónica en el sitio de muestreo se produce fundamentalmente en los primeros milímetros de sedimentos.
En la capa S la proporción del P2 y P3 se mantuvo en un 13%; mientras que, en la capa SS el P2 (P-Fe) fue del 9% y, por último, el P3 con solo un 3% (Fig. 5); resultados que podrían explicarse teniendo en cuenta que en los sedimentos estuarinos el P-Fe y P-Al se disuelve bajo condiciones fuertemente anaerobias. Así, a medida que aumenta la profundidad del sedimento disminuye la concentración de oxígeno lo que aumentaría la disolución de esta fracción de P debido a la reducción de Fe3+ a Fe2+ (más soluble) y existiría una difusión PO43- vía agua intersticial (Yamada & Kayama 1987; Hanrahan et al. 2005). Según Jensen et al. (1995), dicha liberación de PO43- estaría a su vez ligada a la reducción de sulfatos. La importancia de la reducción de sulfatos en la “liberación” del P se asocia principalmente a dos mecanismos: por un lado, los sulfuros producidos son primeramente responsables de la reducción de los oxi-hidróxidos férricos (FeOOH) y la liberación del Fe unido al P, y por el otro, la precipitación de FeS y FeS2 disminuye la presencia de sitios de adsorción en función de los FeOOH, de este modo se restringe la migración del Fe+2 pero no la de los PO43- disueltos a través del agua intersticial. Estas últimas consideraciones se corroboran en el ambiente estudiado mediante las altas concentraciones de PO43- detectadas en el agua intersticial (de hasta 223 µM) tal como se ha expresado anteriormente (Spetter et al. 2015a).
Cabe mencionar que, luego de obtener la concentración de P total a través de la sumatoria de las fracciones de P extraídas en la extracción secuencial, se observó que se estarían produciendo errores por exceso, sobreestimando la concentración de P total de este modo. Este hecho probablemente es debido a un efecto de la matriz, lo que podría eliminarse en futuros estudios mediante el uso de material de referencia tal como lo recomienda Lukkari et al. (2007). Por tal motivo, fue de suma importancia contar con el valor de concentración de P total obtenida luego de la digestión en medio ácido.
Debido a la escasez de trabajos respecto al conocimiento de la estructura química del fósforo en sus formas orgánica e inorgánica en el sedimento, este primer estudio realizado en los sedimentos de la planicie de marea del estuario medio de Bahía Blanca es de suma importancia para estudios posteriores en sedimentos estuarinos. Se observaron altas concentraciones de fósforo total en los sedimentos supramareales de Puerto Rosales, lo que refleja la capacidad de estos sedimentos para retener el fósforo. La composición granulométrica del sedimento estaría favoreciendo esta retención del fósforo; mientras que la inundación la estaría afectando, especialmente en el caso el P-lábil o adsorbido. El orden de abundancia de las fracciones de fósforo identificadas en los sedimentos de la capa superficial de la planicie de marea supramareal de Puerto Rosales fue el siguiente: P-Ca > P-refractario o residual > P-Fe = P-moderadamente lábil > P-lábil o adsorbido; mientras que para la capa sub-superficial fue: P-Ca > P-refractario o residual > P-lábil o adsorbido > P-Fe > P-moderadamente lábil. La presencia de una abundante concentración de PO43- en agua intersticial reportada en estudios previos podría ser una consecuencia de diversos procesos que deben ser aun mayormente estudiados tales como la reducción del Fe3+, la presencia de sulfatos/sulfuros, la disolución de compuestos de P-Al y P-Fe, y la presencia de microorganismos.
Si bien es necesario considerar la utilización de material de referencia para evitar la sobreestimación de la concentración del fósforo total proveniente de las extracciones secuenciales; los resultados obtenidos en este caso proveen de una novedosa e importante información para futuros estudios tanto en la zona costera del estuario de Bahía Blanca como en otros ambientes marino-costeros del mundo.
Agradecemos al comité organizador de la V RAGSU (V Reunión Argentina de Geoquímica de la Superficie) que nos permitió presentar el presente trabajo. También al Lic. J. Arlenghi por su asistencia en el trabajo de campo, al Dr. W.D. Melo por la realización del mapa, a los directores del IADO (CONICET/UNS, CCT-BB) por permitirnos utilizar el equipamiento y la infraestructura del Laboratorio de Química Marina. Este trabajo fue financiado por la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT, PICT -2007-00374) y la Universidad Nacional del Sur (PGI 24/Q028 y 24/Q109); ambas de Argentina.
Agradecemos al comité organizador de la V RAGSU (V Reunión Argentina de Geoquímica de la Superficie) que nos permitió presentar el presente trabajo. También al Lic. J. Arlenghi por su asistencia en el trabajo de campo, al Dr. W.D. Melo por la realización del mapa, a los directores del IADO (CONICET/UNS, CCT-BB) por permitirnos utilizar el equipamiento y la infraestructura del Laboratorio de Química Marina. Este trabajo fue financiado por la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT, PICT -2007-00374) y la Universidad Nacional del Sur (PGI 24/Q028 y 24/Q109); ambas de Argentina.

Figura 1.
Mapa indicando la ubicación del estuario de Bahía Blanca y el sitio de estudio, Puerto Rosales (Pcia. de Buenos Aires, Argentina)

Figura 2.
Diagrama del método utilizado para la extracción y determinación de fósforo inorgánico en los sedimentos estuarinos

Figura 3.
Distribución de la temperatura del sedimento superficial y la temperatura ambiente en Puerto Rosales durante el invierno de 2011. Datos de temperatura ambiente máxima y mínima extraídos del Servicio Meteorológico Nacional publicados en el diario La Nueva Provincia
http://www.lanueva.com/clima/
Porcentaje de humedad (%H) y de materia orgánica (%MO) en la capa S (0-5 mm prof.) y SS (5-10 mm prof.), y valores de pH, Eh y temperatura (T) en los sedimentos superficiales de la planicie de marea supramareal de Puerto Rosales (zona media del estuario de Bahía Blanca)


Figura 4.
Concentración media de fósforo total en sedimentos de la capas S y SS en la planicie de marea supramareal de Puerto Rosales, durante la época fría de 2011. Letras diferentes representan diferencias significativas (p < 0,05)
Concentración de fósforo total (PT, mg P g-1 ps) en sedimentos de algunas áreas costeras en comparación con este estudio.

Concentración de las distintas fracciones de fósforo (promedio ± desvío estándar, mínimos y máximos expresados en mg P/g ps) extraídas de los sedimentos de la planicie supramareal de Puerto Rosales durante la época fría de 2011


Figura 5.
Distribución porcentual de las distintas fracciones de fósforo extraídas del sedimento superficial y sub-superficial en la planicie de marea de Puerto Rosales durante el invierno de 2011


