Artículos
INFLUENCIA DE DOS BIOESTIMULANTES EN EL COMPORTAMIENTO AGRÍCOLA DEL CULTIVO DEL TABACO (Nicotiana tabacum L.)
INFLUENCE OF TWO BIO-STIMULANTS IN AGRICULTURAL BEHAVIOR IN TOBACCO CROP (Nicotiana tabacum L.)
INFLUENCIA DE DOS BIOESTIMULANTES EN EL COMPORTAMIENTO AGRÍCOLA DEL CULTIVO DEL TABACO (Nicotiana tabacum L.)
Revista de la Facultad de Ciencias, vol. 8, núm. 1, 2019
Universidad Nacional de Colombia
Recepción: 16 Septiembre 2018
Aprobación: 22 Octubre 2018
Resumen: Con el objetivo de evaluar el efecto de dos bioestimulantes en el comportamiento agrícola del cultivo del tabaco negro ‘Sancti Spíritus 2006’, se desarrolló un experimento en la Cooperativa de Créditos y Servicios “Sindulfo García”, Sancti Spíritus, Cuba, de octubre a diciembre de 2015. Se evaluaron los siguientes tratamientos: control, inoculación al suelo y aplicación foliar de ME-50 a 100 mg L−1, aplicación foliar de Biobras-16 R a 0.05 mg L−1 y la combinación de ambos. Las principales observaciones correspondieron a las siguientes variables morfoagronómicas: distancia entre nudos (cm), largo y ancho de las hojas centrales (cm), altura de las plantas (cm) y el número de hojas por planta. Los resultados mostraron que la aplicación de los bioestimulantes ME-50, Biobras-16 R , así como su combinación incrementaron las variables morfológicas en la variedad de tabaco negro ‘Sancti Spíritus 2006’. Los mayores resultados fueron logrados con la aplicación combinada de los dos bioestimulantes porque incrementaron los indicadores observados comparada con la utilización individual de ME-50 y BB-16 e incrementó el número de hojas por planta en relación al tratamiento control en 35.51% a los 64 ddt.
Palabras clave: Aplicación foliar, brasinoesteroides, crecimiento, microorganismos eficientes.
Abstract: With the objective of to evaluate the effect of two biostimulants on the agricultural behavior of the black tobacco crop ‘Sancti Spíritus 2006’ was developed an experiment in the collective framer “Sindulfo García”, Sancti Spíritus, Cuba, from october to december 2015. The following treatments were evaluated: control, inoculation and foliar application of ME-50 at 100 mg L−1, foliar application of Biobras-16 R at 0.05 mg L−1 and the combination of both. The main observations corresponded to the following morpho-agronomic variables: distance between nodes 31 (cm), length and width of central leaves (cm), height of plants (cm) and the number of leaves per plant. The results showed that the application of the biostimulants ME-50, Biobras-16 R , as well as their combination increased the morphological variables in the variety of black tobacco ‘Sancti Spíritus 2006’. The highest results were obtained with the combined application of the two biostimulants because they achieved the indicators observed compared with the individual use of ME-50 and BB-16 and increased the number of leaves per plant in relation to the control treatment in 35.51% at 64 ddt.
Keywords: Brassinosteroids, efficient microorganism, foliar application, growth.
1. INTRODUCCIÓN
El cultivo del tabaco, según afirmaciones de Espino (1993) y Díaz (2002), es una planta puramente americana, ya que era desconocida en Europa al ser descubierto el nuevo mundo. La importancia del tabaco radica en el creciente consumo de éste, además posee un alto valor económico en la exportación y goza de alto reconocimiento internacional por su calidad. En Cuba el tabaco constituye uno de los principales rubros exportables, por lo que es de interés general procurar el incremento de sus rendimientos, en ello juega un importante papel la lucha biológica, los biofertilizantes y bioestimulantes (Cruz & González, 2008). En la actualidad resulta de gran importancia investigar y encontrar las variantes que nos permitan el desarrollo de una agricultura rentable y menos contaminante del medio ambiente (Deming, 1998).
El uso de reguladores del crecimiento en la producción agrícola se ha convertido en una práctica internacional al ser reconocidos sus beneficios a los cultivos (Martínez et al., 2004). Los brasinoesteroides (BR) representan la nueva sexta clase de hormonas vegetales con ocurrencia en el reino vegetal, son hormonas vegetales promotoras del crecimiento con estructuras similares a los esteroides animales. Las BR tienen una singularidad de efectos biológicos sobre el crecimiento y desarrollo de las plantas (Sasse, 1997; Sasse, 1999). Las BR son fitohormonas que controlan importantes funciones de desarrollo, como la promoción del alargamiento y la división celular, la fertilidad, la germinación de semillas, la senescencia, el retraso de la abscisión y la promoción de la biosíntesis de etileno (Sasse, 1999; Bajguz & Tretyn, 2003). Con la aplicación de estos derivados en Cuba, se han reportado incrementos en los rendimientos de cultivos, en frijol (Rosabal et al., 2013), lechuga (Arteaga et al., 2013), arroz (Díaz et al., 2003; Núñez et al., 2006) y en tabaco (González et al., 2005).
Por otra parte, los microorganismos eficientes, una tecnología desarrollada por el profesor Teuro Higa, quien demostró, que el éxito de su efecto potencializado estaba en su mezcla (Higa, 1997; Higa, 2013). Desde entonces, esta tecnología ha sido investigada, desarrollada y aplicada en una multitud de usos agropecuarios y ambientales, y es utilizada en más de 80 países del mundo (Arias et al., 2010). Otros autores refieren que el principio fundamental de esta tecnología consiste en la introducción de un grupo de microorganismos benéficos que mejoran las condiciones del suelo y la eficacia del uso de la materia orgánica (Pedraza et al., 2010). Por otra parte, diversos estudios han reportado sus efectos benéficos, porque su introducción ha favorecido y beneficiado a los agricultores (Luna & Mesa, 2016) y la producción de varios cultivos, como en frijol (Calero et al., 2016; Calero et al., 2017), hortalizas (Álvarez et al., 2012; Liriano et al., 2015; Olivera et al., 2015; Núñez et al., 2017), maíz (Peña et al., 2016) y arroz (Milian et al., 2014).
Si es conocido que la utilización de los biofertilizantes y bioestimulantes desde el establecimiento inicial del cultivo, son esenciales para el éxito de la producción, la hipótesis a constatar es que la aplicación de ME-50 combinada con Biobras-16 R podría estimular y aumentar la producción de tabaco. Para comprobar esta hipótesis, el objetivo de la investigación fue evaluar el efecto de dos bioestimulantes en el comportamiento agrícola del cultivo del tabaco negro ‘Sancti Spíritus 2006’.
2. MATERIALES Y MÉTODOS
2.1. Ubicación del experimento y material vegetal
La investigación se desarrolló en la CCS “Sindulfo García”, municipio Taguasco, provincia de Sancti Spíritus, Cuba, de noviembre a diciembre de 2015. Se utilizó la variedad ‘Sancti Spíritus 2006’ (‘SS 2006’), recomendada para su cultivo en las provincias centrales del país, por el tipo de suelo predominante y donde no haya problema con la disponibilidad de agua, sólo se debe utilizar para el cultivo a pleno sol y recolección en mancuernas. El trasplante se realizó de forma tradicional a la distancia de 0.90 m entre líneas y 0.30 m entre plantas, para obtener alrededor de 37037 plantas ha−1. Las posturas provinieron de un semillero tradicional y las variables climáticas observadas durante el desarrollo del experimento fueron registradas por la estación de recursos Hidráulicos del Municipio de Taguasco, situada a 500 m del lugar, la temperatura media diaria fue de 21.55 ◦C, la humedad relativa media diaria 87.05% y la precipitación pluvial acumulada de 127.15 mm.
2.2. Diseño experimental
Se utilizó un diseño experimental de bloques al azar, con cuatro tratamientos y cinco repeticiones, para formar 20 parcelas experimentales, el tamaño de las parcelas fue de 14.40 m2, el área efectiva de 1.98 m2 y la total de 0.41 ha. Los tratamientos evaluados fueron los siguientes:
Control (estándar). Según lo orientado en el instructivo técnico para el cultivo del tabaco 2014.
Inoculación al suelo y aplicación foliar del bioestimulante ME- 50 a la concentración de 100 mg L−1. Aplicación foliar de Biobras-16 R (BB-16) a la dosis de 0.05 mg L−1.
Inoculación al suelo con ME-50 y aplicaciones foliares combinada de ME-50+BB-16 mezclados a las concentraciones y dosis antes mencionadas.
El modo de aplicación de los bioestimulantes ME-50 y BB-16 están expuestos en la Tabla 1, fueron aplicados de forma foliar en las etapas de roseta y vegetativa a los 10, 20 y 30 días después del trasplante (ddt) y al suelo solamente ME-50 en el momento del trasplante, con apoyo de una asperjadora manual (ECHO MS-21H) de 7.6 litros de capacidad.
| Tratamientos | Modo de aplicación | |||
| Suelo | Etapa Roseta 10 ddt | Vegetativa 20 ddt | Vegetativa 30 ddt | |
| Control | - | - | - | - |
| ME-50 | 100 mg L−1 | 100 mg L−1 | 100 mg L−1 | 100 mg L−1 |
| BB-16 | 0.05 mg L−1 | 0.05 mg L−1 | 0.05 mg L−1 | |
| ME-50+BB-16 | 100 mg L−1 | 100 mg L−1+ | 100 mg L−1+ | 100 mg L−1+ |
| 0.05 mg L−1 | 0.05 mg L−1 | 0.05 mg L−1 |
2.3. Características de los bioestimulantes utilizados
El Biobras-16 R y el inóculo de ME-50 fueron adquiridos en la Sucursal de Labiofam de Sancti Spíritus, el primero cuyo ingrediente activo es un análogo espirostánico de brasinoesteroide fórmula global C27H42O5, conocida como Biobras-16 R (BB-16), a diferentes concentraciones (10-10-10-6 mol L−1), con una concentración de principio activo de 0.1 mg mL−1, líquido soluble en agua y pH: 5-6, desarrollado por el Centro de Productos Naturales (CEPN) de la Facultad de Química y el inóculo de microorganismos eficientes (ME-50) compuesto por Bacillus subtilis B/23-45-10 Nato (5.4 104 ucf mL−1), Lactobacillus bulgaricum B/103-4-1 (3.6 104 ucf mL−1), y Saccharomyces cereviciae L-25-7-12 (22.3 105 ucf mL−1), con certificado de calidad emitido por ICIDCA, código R-ID-B-Prot-01-01, realizado según la metodología propuesta por Olivera et al. (2014).
2.4. Tipo de suelo y principales características
El suelo del experimento fue clasificado como Pardo Sialítico Carbonatado según los criterios de Hernández et al. (2015), que se corresponde con los Cambisoles según la Word Reference Base (IUSS, 2015). Este tipo de suelo es representativo de la región y presenta un perfil ABC, de mediana a poca profundidad, adecuado para el cultivo del tabaco y para la variedad en estudio, con predominio de arcillas del tipo 2:1 Montmorillonita.
2.5. Variables evaluadas
Se realizaron tres evaluaciones durante el ciclo de producción agrícola del cultivo según la metodología propuesta por Espino (2006), desarrollándose las observaciones a los 21, 42 y 64 ddt, en el área efectiva a 50 plantas por tratamientos y las variables fueron: la distancia entre nudos (cm), longitud y ancho promedio de las hojas centrales, altura de las plantas (cm) y el número de hojas por planta.
2.6. Análisis estadístico
Los datos obtenidos fueron analizados por medio de estadística descriptiva de variables continuas, para distribución normal, según test de Kolmogorov-Smirnov (Allen, 1976) para la bondad de ajuste y se aplicó la prueba Dócima de Levene para evaluar la homogeneidad de la varianza. Cuando existió normalidad y homogeneidad se realizó un análisis de varianza simple (ANOVA), cuando éste fue significativo al 5% de probabilidad de error, las medias fueron comparadas por la prueba de Rangos Múltiples de Tukey (p<0.05).
Los datos fueron procesados en el software estadístico AgroEstat R (Barbosa & Maldonado, 2014).
3. RESULTADOS Y DISCUSIÓN
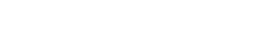
La distancia entrenudos en las plantas de tabaco, variedad ‘SS-2006’, fue significativo (p<0.05) en los tres momentos evaluados (Figura 1). Los mejores resultados fueron logrados por la aplicación combinada de ME-50+BB-16 al superar a los tratamientos individuales de ME-50 y BB-16 y al control, con incrementos a los 21 ddt de 44.51% (Figura 1(A)), 26.93% a los 42 (Figura 1(B)) y de 11.82% un día antes de la cosecha (64 ddt) (Figura 1(C)) en relación al tratamiento sin bioestimulantes.
La distancia entrenudos es un indicador que facilita la recolección de las hojas, sobre todo cuando éstas son colectadas en mancuernas, cuando éste es cultivado en la forma sol en palo, porque beneficia el corte manual con la menor ocurrencia de daños mecánicos. Estos resultados corroboran lo planteado por Farouk & Amany (2012) y Sudisha et al. (2012) quiénes consideraron que los bioestimulantes actualmente son utilizados como biorreguladores del desarrollo de las plantas, pues pueden regular la síntesis y acción de las hormonas y distintos procesos de organogénesis y crecimiento y de manera directa y específica regulan muchos de los procesos fisiológicos que se traducen en la formación de órganos en las plantas. En este sentido, Martínez et al. (2004) con la utilización del BB-16 en distintas dosis y momentos de aplicación no tuvo efectos sobre algunas variables del crecimiento como la longitud del tallo y la distancia entre nudos. Resultados similares para esta etapa los obtuvieron Mariña et al. (2010) en las plantas asperjadas con Fitomas-E a 0.8 L ha−1, con incrementos en la longitud del entrenudo, con respecto a los demás tratamientos y el testigo sin aplicación.
La longitud promedio de las hojas centrales de la variedad de tabaco ‘SS 2006’ fue significativa (P<0.05) y superior en los tratamientos con los bioestimulantes en relación al tratamiento control (Figura 2). Los mayores resultados fueron alcanzados en los tres momentos evaluados con el tratamiento ME-50+BB-16 con diferencias significativas con las aplicaciones individuales de ME-50 y BB-16 e incrementar los valores promedio de este indicador en 28.01% a los 21 ddt (Figura 2(A)), 28.06% a los 42 ddt (Figura 2(B)) y de 11.32% 64 ddt (Figura 2(C)).
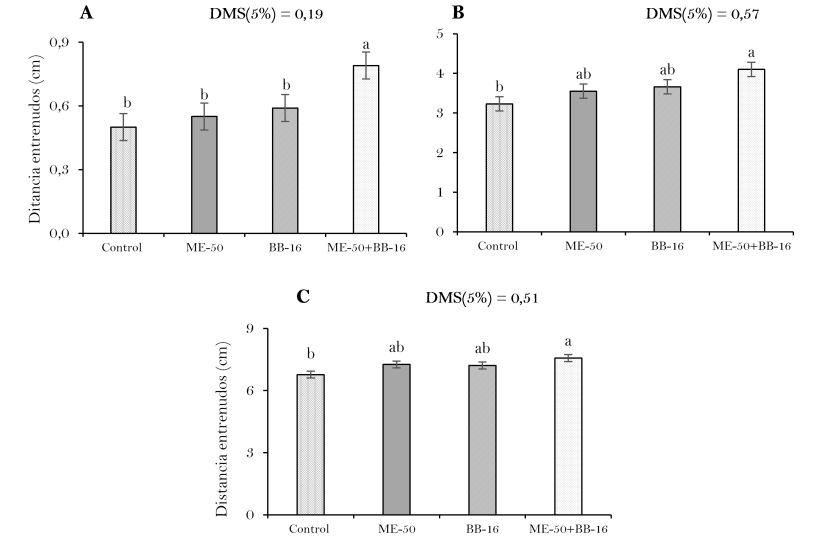
Valores representados por las medias (n=5) + desviación estándar (DE). Letras diferentes en las barras muestran diferencias significativas según Tukey (P<0.05).
Elaboración propia.El fruto agrícola del tabaco es la hoja, un incremento del tamaño de ésta conlleva a un mayor rendimiento. En este aspecto, Martínez et al. (2004) obtuvieron un efecto significativo (P≤0,05) de las distintas dosis y momentos de aplicación sobre la longitud de la hoja mayor al utilizar BB-16. De acuerdo con Espino (2009), el mayor número de hojas que presenta una planta, hasta cierto límite, porque un desbotonado demasiado alto (20 hojas) disminuye el peso individual de la hoja y el detrimento en la producción de rebrotes reduciendo significativamente el rendimiento agrícola total.
Resultados similares a los alcanzados en este trabajo, fueron obtenidos por Mariña et al. (2010), con la aplicación de Fitomas-E como bioestimulante, incrementaron la longitud de la hoja, en relación al testigo. Por otra parte, Terry et al. (2005) demostraron que la acción combinada de microorganismos benéficos y productos bioactivos son una alternativa para mejorar la calidad nutricional en el cultivo, con la menor aplicación de productos fertilizantes inorgánicos.
Valores representados por las medias (n=5) + DE. Letras diferentes en las barras muestran diferencias significativas según Tukey (P<0.05).
Elaboración propia.La aplicación de los bioestimulantes en relación al tratamiento control aumentaron el ancho promedio de las hojas centrales (Figura 3), con destaque para la aplicación asociada de ME-50 + BB-16 con diferencias significativas (P<0.05) en relación a la utilización individual de los bioestimulantes ME-50 y BB-16 y el tratamiento control, con incrementos con respecto a la variante sin aplicación de 28.30% a los 21 ddt (Figura 3(A)), 31.14% a los 42 ddt (Figura 3(B)) y de 15.32% a los 64 ddt (Figura 3(C)).
En relación a este indicador, Díaz (2002) obtuvo en un ensayo con el cv. Criollo, que la aspersión foliar a los 20 y 50 ddt, favoreció el incremento de la anchura de las hojas. De acuerdo con González et al. (2005) la aspersión foliar de BB-16 a los 30 ddt en la variedad ‘SS-96’, incrementó en el ancho de las hojas centrales en relación al control sin aplicación. Los resultados obtenidos corroboran lo alcanzado por Cruz & González (2008) quiénes utilizaron diferentes sustancias bioestimulantes, para promover incrementos significativos de los rendimientos agrícolas del cultivo y observaron que todos los tratamientos aventajaron significativamente al control.
Por otra parte, Hernández et al. (2008) lograron los mayores valores del rendimiento, cuando la planta tenía entre 14 y 16 hojas, cosechada a los 69 días, lo que manifiesta que este indicador no sólo depende de las dimensiones de la hoja y el contenido de materia seca, sino también del número de hojas por planta y el momento de cosecha. Resultados obtenidos para esta etapa fueron similares a los obtenidos por Mariña et al. (2010) quiénes obtuvieron con la aplicación de Fitomas-E como bioestimulante que las hojas centrales fueron superiores al testigo.
Valores representados por las medias (n=5) + DE. Letras diferentes en las barras muestran diferencias significativas según Tukey (P<0.05).
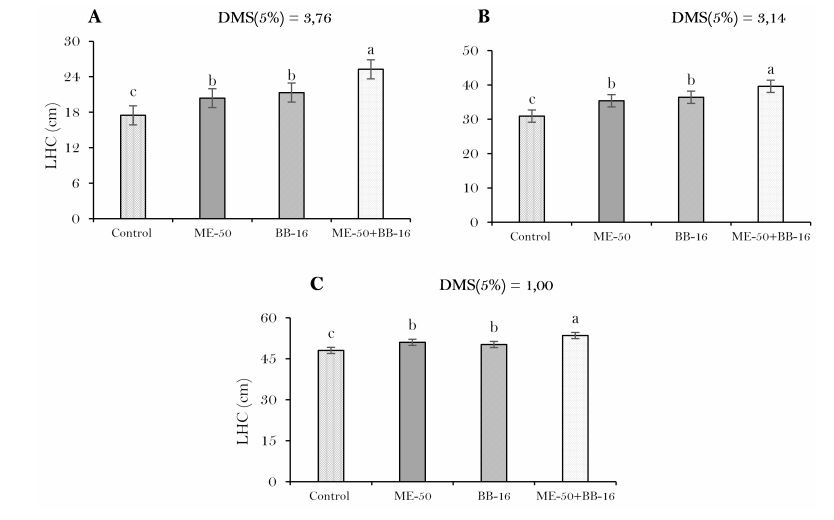
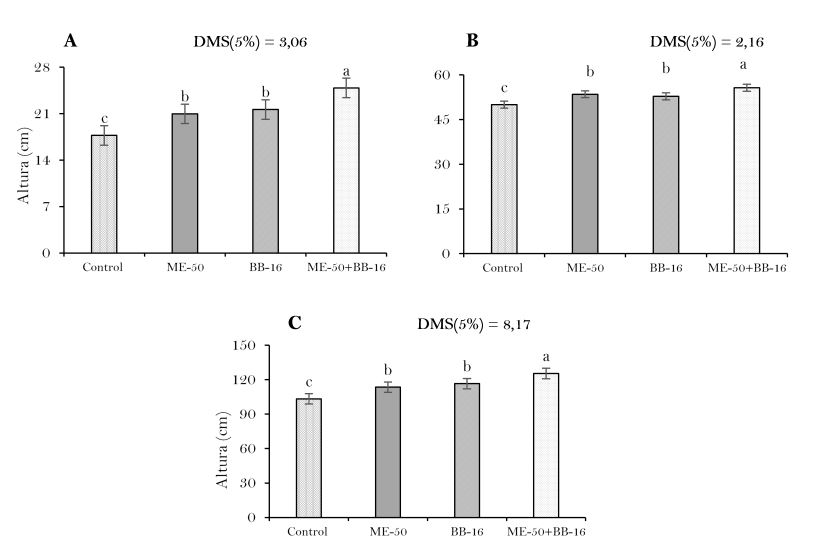
Elaboración propia.La altura de las plantas de tabaco fue significativa (P<0.05) y estimulada por los bioestimulantes en relación al tratamiento control (Figura 4), con destaque para la aplicación combinada de ME-50 + BB-16 a los 21, 42 y 64 ddt, con incrementos en la altura de las plantas de 40.41% a los 21 ddt (Figura 4(A)), 11.27% a los 42 ddt (Figura 4(B)) y a los 64 ddt en 21.36% (Figura 4(C)) en relación al tratamiento control.
Este comportamiento de la altura de las plantas, coincide con los criterios expuestos por por Adam & Petzold (1994), quienes plantearon que los BR promueven el crecimiento vegetal por la estimulación de la división y el alargamiento celular. De acuerdo con Zullo & Adam (2002), estos compuestos actúan también sobre la activación de los procesos metabólicos vinculados al crecimiento y desarrollo debido a la aplicación del bioestimulante.
El efecto positivo y significativo con la aplicación de BB-16 sobre el crecimiento inicial de las plantas tabaco fue demostrado por Martínez et al. (2004). Por otra parte, efectos benéficos no han sido encontrados con la aplicación de ME en este cultivo, pero varios autores han reportados incrementos de las plantas en cultivos como el frijol (Calero et al., 2017), zanahoria (Núñez et al., 2017), maíz (Peña et al., 2016) y en arroz (Milian et al., 2014). En este sentido, Terry et al. (2005) obtuvieron con el uso combinado de microorganismos benéficos y productos bioactivos como alternativa para la producción de tomate, obtuvieron un efecto positivo
Valores representados por las medias (n=5) + DE. Letras diferentes en las barras muestran diferencias significativas según Tukey (P<0.05)
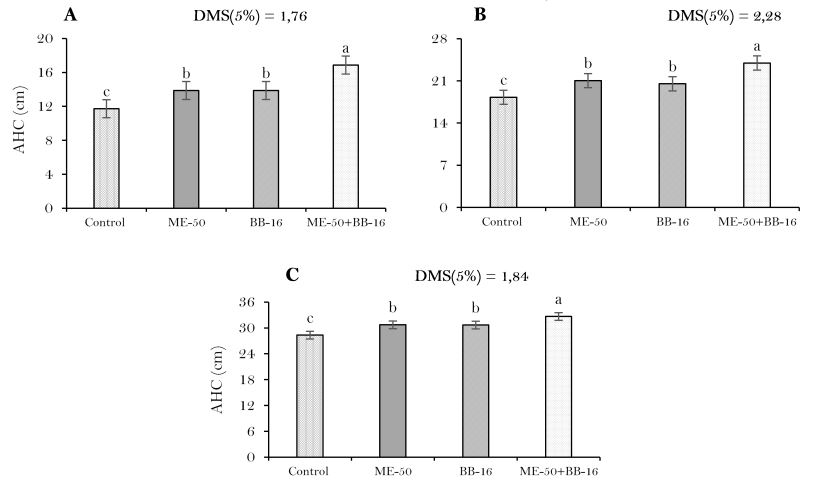
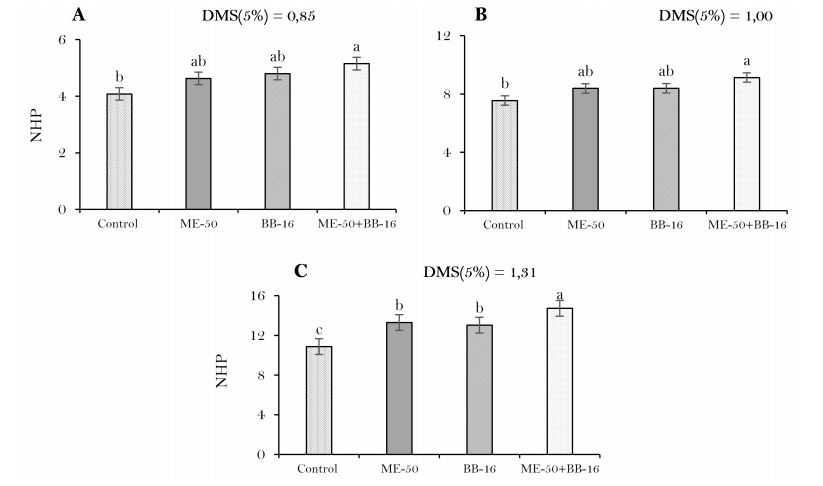
Elaboración propia.Todos los bioestimulantes aumentaron significativamente (P<0.05) la producción de hojas en relación al tratamiento control (Figura 5), con aumentos más pronunciados para el tratamiento combinado ME-50 + BB-16 en los tres momentos evaluados, sin diferencias significativas con los bioestimulantes individuales ME-50 y BB-16 a los 21 y 42 ddt, pero si con el tratamiento sin bioestimulantes y aumentos de 14.36 y 20.90% respectivamente (Figura 5(A) y 5(B)), mientras que a los 64 ddt fue significativa con incrementos en relación a las formas individuales de 11.89% y de 35.51% en relación al tratamiento control (Figura 5(C)).
Las comunidades bacterianas dentro de las plantas tienen un gran impacto en la calidad de las plántulas y el rendimiento de las diferentes variedades (Xu et al., 2014). De acuerdo con Martínez et al. (2004) la aplicación de diferentes dosis de BB-16 incrementaron la producción de hojas útiles.
En relación a este indicador, Díaz et al. (2009) incrementaron y mejoraron el crecimiento del follaje (22%) con aspersiones foliares con ME y de esta manera aumentaron el área fotosintética, la cual incrementa la elaboración de nutrimentos para la planta y un incremento de su productividad. Por su parte Terry et al. (2005) demostraron que el estudio combinado de microorganismos benéficos y productos bioactivos constituye una combinación beneficiosa, porque propiciaron un mayor incremento del rendimiento del cultivo.
Resultados similares a los obtenidos en la investigación, fueron alcanzados por Álvarez et al. (2013) quiénes demostraron que la utilización de bioestimulantes mejoró la calidad de los frutos agrícolas y logró una reducción significativa con respecto al control. Autores como Liriano et al. (2015) con la aplicación de ME individual y combinada con T. harzianum aumentaron el número de hojas y el área foliar en plántulas de cebolla en relación al tratamiento control. En diferentes trabajos desarrollados con la utilización de bioestimulantes, coinciden en conferirles a estos productos una gran importancia al ser capaces de influir en diferentes procesos fisiológicos que ocurren en el vegetal que hace que estimulen el crecimiento y desarrollo de las plantas (Kollárová & Zelko, 2007; Field et al., 2009).
Valores representados por las medias (n=5) + DE. Letras diferentes en las barras muestran diferencias significativas según Tukey (P<0.05).
Elaboración propia.4. CONCLUSIONES
La aplicación de los bioestimulantes ME-50, Biobras-16 R , así como su combinación incrementaron las variables morfológicas evaluadas en la variedad de tabaco negro ‘Sancti Spíritus 2006’ comparado con el tratamiento control. Los mayores resultados fueron logrados con la aplicación combinada de los dos bioestimulantes porque incrementaron los indicadores observados comparado con la utilización individual de ME-50 y BB-16 e incrementó el número de hojas por planta en relación al tratamiento control en 35.51% a los 64 ddt.
Referencias
Adam, G. & Petzold, U. (1994). Brassinosteroide–eine neue Phytohormon-Gruppe? Naturwissenschaften, 81(5), 210–217.
Allen, M. E. (1976). Kolmogorov-Smirnov test for discrete distributions [en línea] (Doctoral dissertation, Master Thesis, Naval Postgraduate School, Monterey, California, 93 p.,[Consultado: 18 de noviembre de 2017], Disponible en: http://calhoun. nps. edu/handle/10945/17830.
Álvarez, B. I.; Reynaldo, E. I.; Cartaya, R. & Terán, V. (2013). Efectos de una mezcla de oligogalacturónidos en hortalizas de importancia económica. Cultivos Tropicales, 32(3), 69–74.
Álvarez, J., Núñez, D., Liriano, R. & Terence, G. (2012). Evaluación de la aplicación de microorganismos eficientes en col de repollo (Brassica oleracea L.) en condiciones de organopónico semiprotegido. Centro Agrícola, 39(4), 27–30.
Arias, A. (2010). Microorganimos eficientes y su beneficio para la agricultura y el medio ambiente. Journal de Ciencia e Ingeniería, 2(2), 42–45.
Arteaga, M. C. J.; Gómez, L. G. G.; Rodríguez, A. F. & Montero, S. E. (2013). Evaluación de tres bioestimulantes en lechuga en condiciones de organopónico. Centro Agrícola, 40(1), 79–82.
Bajguz, A. & Tretyn, A. (2003). The chemical structures and occurrence of brassinosteroids in plants. In Brassinosteroids (pp. 1-44). Springer, Dordrecht.
Barbosa, J. C. & Maldonado Júnior, W. (2014). AgroEstat: sistema para análises estatísticas de ensaios agronomicos. Jaboticabal: Faculdade de Ciencias Agrárias e Veterinárias, Unesp.
Calero, A.; Pérez, Y. & Pérez, D. D. (2016). Efecto de diferentes Biopreparados combinados con FitomasE en el comportamiento agroproductivo del frijol común (Phaseolus vulgaris L.). Revista Científica Monfragüe Desarrollo Resiliente, 7(2), 161–76.
Calero, A.; Quintero, E. & Pérez, Y. (2017). Utilización de diferentes bioproductos en la producción de frijol común (Phaseolus vulgaris L). Agrotecnia de Cuba, 41(1), 1–13.
Cruz, F. & González, N. (2008). Influencia de las aplicaciones del Bion y algunos bioestimulantes en la incidencia de organismos plagas en el tabaco (Nicotiana tabacum L.). Revista Electrónica Granma Ciencia, 12(2), 1–7.
Deming, W. E. (1998). Calidad, productividad y competitividad: la salida de la crisis. Ediciones Díaz de Santos.
Díaz, E. (2002). Efecto de la densidad de plantación sobre el rendimiento y calidad del tabaco negro tapado variedad ‘Corojo’ en los suelos ferralíticos rojos en la zona de partido. Ciencia y Técnica en la Agricultura, 4(1), 21–43.
Díaz, O.; Mercedes, D. & Robayo, M. (2009). Acción de microorganismos eficientes sobre la actividad de intercambio catiónico en plántulas de Acacia (Acacia melanoxylon) para la recuperación de un suelo del municipio de Mondoñedo, Cundinamarca. Colombia Forestal, 12, 141–160.
Díaz, S.; Morejón, R. & Nuñez, M. (2003). Influencia del Biobras-16 en el rendimiento y otros caracteres en el cultivo del arroz (Oryza sativa L.). Cultivos Tropicales, 24(2), 35–40.
Espino, E. (1993). Mejoramiento genético del tabaco cubano (Nicotiana tabacum L.). Desarrollo y Perspectivas. La Habana, Cuba: Instituto de Investigaciones del Tabaco.
Espino, E. (2006). Manual práctico del supervisor agrícola del tabaco. La Habana, Cuba: Instituto de Investigaciones del Tabaco.
Espino, E. (2009). Guía para el cultivo del tabaco 2009-2010. La Habana, Cuba: Instituto de Investigaciones del Tabaco.
Farouk, S. & Amany, A. R. (2012). Improving growth and yield of cowpea by foliar application of chitosan under water stress. Egyptian Journal of Biology, 14(1), 14–16.
Field, R.; Hawkins, B. A.; Cornell, H. V.; Currie, D. J.; Diniz-Filho, J. A. F.; Guégan, J. F.; Kaufman, D.M.; Kerr, J. T.; Mittelbach, G. G.; Oberdorff. T.; O’Brien, E. M. & Turner, J. R. G. (2009). Spatial species-richness gradients across scales: a meta-analysis. Journal of Biogeography, 36(1), 132–147.
González, L.; Vázquez, M.; Rodríguez, C.; Jiménez, M. & Pérez, J. (2005). Efecto del Biobras-16 en algunos indicadores agronómicos del tabaco, variedad Sancti Spíritus-96. Centro Agrícola, 32(1), 89.
Hernández, A.; Pérez, J.M.; Bosch, D. & Castro, N. (2015). Clasificación de los suelos de Cuba. La Habana, Cuba: Ediciones INCA.
Hernández, J.; Hernández, B. & León, Y. (2008). Comportamiento de la variedad de tabaco negro Corojo 2006 cultivada al sol a diferentes alturas de desbotone. Cubatabaco, 9(1), 9–13.
Higa, T. (1997). Making a world of difference through the technology of effective microorganisms (EM). EM Technologies, Inc.
Higa, T. & Parr, J. F. (2013). Microorganismos Benéficos y efectivos para una agricultura y medio ambiente sostenibles. Maryland (USA): Centro internacional de Investigación de Agricultura Natural, Departamento de Agricultura de los Estados Unidos, 13.
USS Working Group. (2015). World reference base for soil resources 2014 (update 2015). International soil classification system for naming soils and creating legends for soil maps. Rome, Italia: World Soil Resources Reports.
Kollárová, K. & Zelko, M. (2007). Growth and anatomical parameters of adventitious roots formed on mung beans hypocotyls are correlated with galacto glucomannan oligosaccharides. New Forests, 33, 309-323.
Liriano, R.; Núñez, D.; Hernández, L. & Castro, A. (2015). Evaluación de microorganismos eficientes y Trichoderma harzianum en la producción de posturas de cebolla (Allium cepa L.). Centro Agrícola, 42(2), 25–32.
Luna, M. & Mesa, J. (2016). Microorganismos eficientes y sus beneficios para los agricultores. Revista Científica Agroecosistemas, 4(2), 31–40.
Mariña, C.; Nieto, M.; Castillo, P.; Bruqueta, D. & Blaya, R. (2010). Efecto del estimulante Fitomas-E sobre el crecimiento, rendimiento y calidad en tabaco negro cultivado sobre bases agroecológicas. Revista Electrónica Granma Ciencia, 14(3), 15–20.
Mariña, C.; Nieto, M.; Rosabal, A.; Castillo, P. & Pérez, B. (2004). Efecto del análogo de brasinoesteroide Biobras-16 R sobre algunos indicadores del crecimiento en la variedad de tabaco negro Habana 92. Revista Electrónica Granma Ciencia, 8(3), 1–7.
Martínez, L.; Bernsten, R. & Zamora, M. (2004). Estrategias de mercado para los cultivos Centroamericanos. Agronomía Mesoamericana, 2, 121-130.
Martínez, L.; Bernsten, R. & Zamora, M. (2004). Estrategias de mercado para los cultivos Centroamericanos. Agronomía Mesoamericana, 2, 121-130.
Milian, P.; González, J.; Cuellar, E.; Rivero, C.J.; Fresneda, C. & Terrero, W. (2014). Efecto de microorganismos eficientes (ME-50) sobre la morfología y el rendimiento del cultivo del arroz (Oryza sativa) en Aguada de Pasajeros. Revista Científica Agroecosistemas, 2(2), 327–336.
Núñez, D.; Liriano, R.; Pérez, Y.; Placeres, I. & Sianeh, G. (2017). Respuesta de Daucus carota L. a la aplicación de microorganismos nativos en condiciones de organopónico. Centro Agrícola, 44(2), 29– 35.
Núñez, M., Mazorra, L. M., Martínez, L., González, M. C. & Robaina, C. (2006). Influencia de la 24epibrasinólida y un análogo espirostánico de brasinoesteroides en el crecimiento de plántulas de dos variedades de arroz (Oryza sativa L.) en medio salino. Cultivos Tropicales, 27(1), 75–82.
Olivera, D.; Ayala, J.; Calero, A.; Santana, M. & Hernández, A. (2014). Prácticas agroecológicas en la provincia de Sancti Spíritus, Cuba. Microorganismos eficientes (EM), una tecnología apropiada sobre bases agroecológicas. Ciencia, Tecnología, Sociedad, 7(2), 77–83.
Olivera, D.; Leiva, L.; Calero, A. & Meléndrez, J.F. (2015). Empleo de microorganismos nativos multiprópositos (MNM) en el comportamiento agroproductivo de cultivos hortícolas. Agrotecnia de Cuba, 39(7), 34–42.
Pedraza, R.; Teixeira, K.; Fernández, A.; De Salamone, I.; Baca, B.; Azcón, R.; Baldani, V. & Bonilla, R. (2010). Microorganismos que mejoran el crecimiento de las plantas y la calidad de los suelos. Corpoica Ciencia y Tecnología Agropecuaria, 11(2), 155–164.
Peña, K.; Rodríguez, J.C.; Olivera, D.; Fuentes, P.F. & Meléndrez, J.F. (2016). Prácticas agrícolas sostenibles que incrementan los rendimientos de diferentes cultivos en Sancti Spíritus, Cuba. Agronomía Costarricense, 40(2), 117–127.
Rosabal, L.; Martínez, L.; Reyes, Y. & Núñez, M. (2013). Resultados preliminares del efecto de la aplicación de Biobras-16 en el cultivo del frijol (Phaseolus vulgaris L.). Cultivos Tropicales, 34(3), 71–75.
Sasse, J. M. (1997). Recent progress in brassinosteroid research. Physiologia Plantarum, 100(3), 696–701.
Sasse, J. (1999). Physiological actions of brassinosteroids. Brassinosteroids: Steroidal plant hormones, 137– 161.
Sudisha, J.; Sharathchandra, G. R.; Amruthesh, W. K.; Kumar, A. & Shekar, S. H. (2012), Pathogenesis related proteins in plant defense response. Plant Defence: Biological Control, 12, 379–403.
Terry, E.; Leyva, Á. & Hernández, A. (2005). Microorganismos benéficos como biofertilizantes eficientes para el cultivo del tomate (Lycopersicon esculentum Mill). Revista Colombiana de Biotecnología, 7(2), 47–54.
Xu, M.; Sheng, J.; Chen, L.; Men, Y.; Gan, L.; Guo, S. & Shen, L. (2014). Bacterial community compositions of tomato (Lycopersicum esculentum Mill.) seeds and plant growth promoting activity of ACC deaminase producing Bacillus subtilis (HYT-12-1) on tomato seedlings. World Journal of Microbiology and Biotechnology, 30(3), 835–845.
Zullo, M. A. T. & Adam, G. (2002). Brassinosteroid phytohormones, structure, bioactivity and applications. Brazilian Journal of Plant Physiology, 14(3),143–181.
Información adicional
[1] : Calero, A.; Quintero, E.;
Olivera, D.; Peña, K. & Pérez, Y. (2018). Influencia de dos bioestimulantes
en el comportamiento agrícola del cultivo del tabaco (Nicotiana tabacum L.). Rev.
Fac. Cienc., 8(1), 31–44. DOI:
https://doi.org/10.15446/rev.fac.cienc.v8n1.73546 bUniversidad
Estadual Paulista “Júlio de Mesquita Filho” (UNESP). Ave. Prof. Paulo Donate
Castellane S/n, CP: 14884-900,
Jaboticabal, São Paulo, Brasil.
alexcalero34@gmail.com cEmpresa Agropecuaria Agroindustrial de
Taguasco. Tuínucu CP: 62300, Taguasco, Sancti Spíritus, Cuba.
[2] : Centro Universitario
Municipal de Taguasco, “Enreique José Varona” (CUM). Ave José Martí #48, Zaza
del Medio. CP: 62300 Taguasco, Sancti Spíritus. Cuba.
Enlace alternativo
https://revistas.unal.edu.co/index.php/rfc/article/view/73546 (html)