1. INTRODUCCIÓN
El ectoparásito Varroa destructor representa un gran problema sanitario en las colonias de Apis mellifera, debido a que causa disminución en la longevidad de las abejas obreras, afecta el desarrollo de larvas y pupas, tiene un efecto sobre las crías de las abejas ocasionando su pérdida de peso, que va desde un 5% hasta un 25% en los estados inmaduros de las abejas e incluso se han evidenciado daños en alas y otros apéndices del insecto, comprometiendo la sanidad de la colonia (De Jong et al., 1982; Evans & Cook, 2018). Es vector de virus y, sus altas poblaciones, impactan la producción de miel de las colonias, lo cual perjudica tanto a la especie como al sistema productivo apícola (Anderson & Trueman, 2000; Martin & Medina, 2004; De Miranda et al., 2015; Ratnieks & Carreck, 2010; Shen et al., 2005).
Las abejas africanizadas se caracterizan por tener una mayor resistencia natural contra plagas y enfermedades en comparación con las abejas europeas (Sanford, 2006). Entre sus características se encuentra la capacidad que poseen para responder a los niveles de infestación de V. destructor mediante mecanismos de defensa natural como la desoperculación de celdas de cría infestadas por el ácaro y el grooming, lo cual, permite regular los niveles de infestación del ectoparásito en las colonias (Vieira et al., 2000; Moretto & Leonidas, 2003; Martin & Medina, 2004; Mondragón et al., 2003).
Muchas de las alternativas de manejo y control de V. destructor se han basado en el uso de acaricidas de origen químico, comprometiendo la capacidad de respuesta natural que puedan desarrollar las abejas ante el ácaro. En relación con lo anterior, Orantes-Bermejo et al. (2010) encontraron en colonias con más del 30% de mortalidad, 16 moléculas entre plaguicidas (acaricidas) y herbicidas en muestras de polen procesado y cera de la colmena, quedando en consideración este impacto como uno de los responsables de la supervivencia o no de las abejas. De igual forma, Beyer et al. (2018) reportaron que después de aplicar en colonias afectadas por Varroa destructor, moléculas como ácido fórmico, timol y formamidina (Amitraz) de manera individual y mezclándolos entre sí, se podrían presentar menores perdidas de las colonias, pero teniendo en cuenta que la eficacia de estas moléculas está relacionada no sólo con la exposición del ácaro a los acaricidas sino también con las condiciones ambientales al momento de la aplicación.
Sin embargo, los plaguicidas no han resuelto el problema, sino que han llegado a acrecentarlo, provocando el deterioro y vulnerabilidad de las colonias, lo que contribuye significativamente a la propagación y la abundancia de patógenos y parásitos, como es el caso de V. destructor. Por lo tanto, es importante conocer los mecanismos de respuesta natural desarrollados por las abejas africanizadas ante la presencia del ácaro y considerar estos atributos como la base de un programa de mejoramiento genético, que lleve a valorar por parte de los apicultores la introducción o no de controles químicos para disminuir las poblaciones de V. destructor en los sistemas productivos apícolas.
2. MATERIALES Y MÉTODOS
Esta investigación fue desarrollada en el Centro Apícola de la Universidad Nacional de Colombia, sede Medellín. El Apiario está ubicado en el Cerro el Volador (6◦16’0”N, 75◦35’0”W) en Medellín, Colombia a 1600 m.s.n.m, con una temperatura promedio anual de 22 oC y una precipitación de 1431 mm con una distribución bimodal a lo largo del año. Entre agosto de 2016 y abril de 2017 se monitorearon cada 30 días los niveles de infestación de Varroa destructor en adultos y crías de 8 colonias de abejas africanizadas establecidas en colmenas tipo Langstroth. Con los resultados obtenidos fue posible advertir que los niveles de infestación promedio del ácaro en abejas adultas durante todo el muestreo oscilaron entre 4.05% y 7.7%, con una media de 5.8% (d.e 1.78), dicho rango genera un impacto en la colonias entre significativo y notable, de acuerdo con lo propuesto para Colombia por Salamanca et al. (2012), y en cría en un rango entre 5.8% y 10.9%, con un promedio de 8.9% (d.e 2.27). De acuerdo con estos resultados, con la revisión bibliográfica y mediante la observación en campo de las colonias, fue posible evidenciar los comportamientos de defensa natural que han desarrollado las abejas africanizadas, permitiéndoles manejar las poblaciones del V. destructor en sus colonias.
Para el trabajo se tomaron muestras de ácaros de colonias de abejas africanizadas que no han recibido ningún tratamiento para el manejo de V. destructor. Con el propósito de corroborar el mecanismo de defensa natural de desoperculado de celdas con presencia del ácaro, se revisaron las celdas de abejas obreras desoperculadas con pupas en el instar 5, y así determinar el número de celdas con presencia o no del ácaro (adultos y/o ninfas). En el laboratorio, con ayuda del estereoscopio y una pinza entomológica, se extraían las pupas y se examinaba detalladamente cada celda en búsqueda de adultos y/o ninfas de V. destructor. Finalmente, se registraban los datos obtenidos para cada colonia y se clasificaban las celdas con presencia del ácaro y las celdas con ausencia de este.
Adicionalmente, se instaló en el piso de cada colmena una lámina de acetato cubierta con una capa de vaselina, debidamente rotuladas y cubriendo toda el área del piso. Se guardaron las muestras en condiciones ambientales. Posteriormente se observó y cuantificó el número de ácaros machos y las ninfas capturadas.
Con ayuda de una pinza entomológica se realizó la remoción de los ácaros inmersos en la vaselina, podían ser ninfas o adultos y se observaban en el estereoscopio, se clasificaban, para finalmente almacenarlos en alcohol al 60% (ver Figuras 1 y 2).
 Figura 1
Estados inmaduros de V. destructor.
Figura 1
Estados inmaduros de V. destructor.
Los ácaros colectados fueron revisados ventral y
dorsalmente con el fin de evidenciar daños causados por las abejas, como efecto
del comportamiento de grooming. A partir de lo encontrado, se clasificaron los
individuos en adulto con lesión, adulto sin lesión, estados inmaduros con lesión
y estados inmaduros sin lesión, esta información se registró para cada colonia.
De esta forma, se observó el comportamiento de grooming que han desarrollado
las abejas ante la infestación de V.
destructor.
 Figura 2
Estados adultos de V. destructor: hembra diámetro
1.3-1.6 mm (a), macho diámetro 0.7 mm (b).
Elaboración propia.
Figura 2
Estados adultos de V. destructor: hembra diámetro
1.3-1.6 mm (a), macho diámetro 0.7 mm (b).
Elaboración propia.
3. RESULTADOS Y DISCUSIÓN
Se observaron en total 144 celdas desoperculadas,
de las cuales el 52% presentaban V.
destructor, en el 43% no se evidencio el ácaro y el 5% presentó cría
enferma. Este resultado está en concordancia con lo reportado por Vieira et al. (2000), quienes encontraron que
las abejas africanizadas removieron cría infestada por V. destructor, retirando en promedio un 51% de la cría con
presencia del ácaro, mientras que las abejas italianas removieron un 25%.
De igual forma, Vandame et al. (2007), encontraron que en
condiciones naturales las abejas africanizadas removieron el 32.5% de la cría
infestada por V. destructor, mientras
que las abejas europeas sólo un 8%, encontrando una diferencia significativa
entre las especies, además reportan que durante el experimento era más
frecuente ver cría infestada en la abejas europeas que en las africanizadas, es
decir, la tasa de mortalidad de las poblaciones de V. destructor es más alta en las colonias de abejas africanizadas
que en las colonias de abejas europeas. Es así, como éste
comportamiento en las abejas africanizadas del Centro Apícola, de la
Universidad Nacional de Colombia, sede Medellín, ha permitido regular de manera
natural las poblaciones del ácaro en las colonias (ver Figura 3).
 Figura 3
Desoperculación de celdas
de abejas obreras en la cámara de cría: celdas de pupas en el 5 instar desoperculadas (a), cría de V. destructor en celda desoperculada (b),
ácaro adulto en celdas desoperculadas (c).
Elaboración propia.
Figura 3
Desoperculación de celdas
de abejas obreras en la cámara de cría: celdas de pupas en el 5 instar desoperculadas (a), cría de V. destructor en celda desoperculada (b),
ácaro adulto en celdas desoperculadas (c).
Elaboración propia.
De los ácaros adultos colectados el 96.6% fueron hembras y
el 3.4% machos (ver Figura 4). El 11% de las hembras presentaron lesiones y el
16.6% de los machos tenían daños. Adicionalmente, la presencia de ácaros machos
en las trampas de piso es otro aspecto que permite evidenciar el comportamiento
de desoperculado de celdas que realizan las abejas
ante la presencia de V. destructor en
sus crías, puesto que, la fase reproductiva del ácaro se da en las celdas de cría
de las abejas, donde después de 60 horas la hembra del ácaro pone el primer
huevo que usualmente suele ser no fecundado (macho) y continua con posturas de
hembras cada 30 horas, asimismo, la hembra adulta es la única que posee la
capacidad para vivir fuera de las celdas de crías. El macho tiene una función
exclusivamente reproductiva (Ritter, 2001; Rosenkranz et al., 2010; Evans & Cook, 2018).
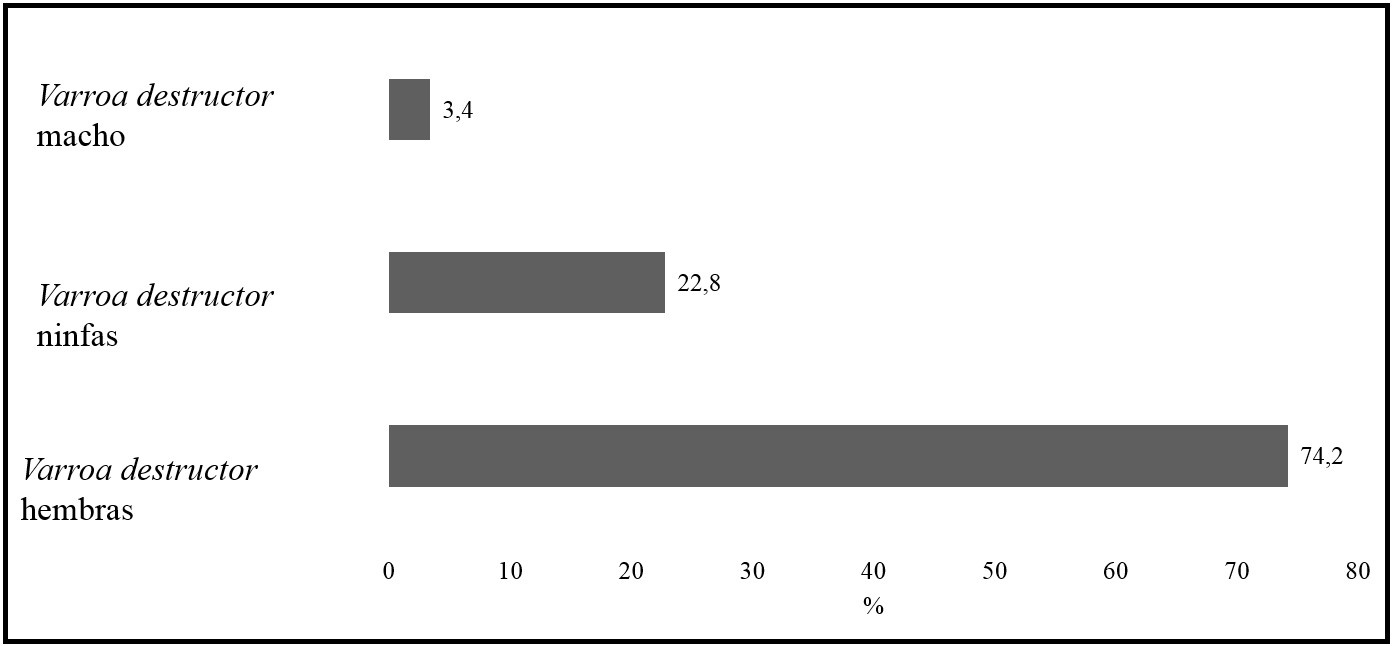 Figura 4
Porcentaje de V.
destructor colectados en las trampas de piso
Elaboración propia.
Figura 4
Porcentaje de V.
destructor colectados en las trampas de piso
Elaboración propia.
En total se colectaron 232 ácaros
en las trampas de piso, de los cuales el 77.2% corresponden a ácaros adultos y
el 22.8% a ninfas. Se halló que el 19.4% presentó lesiones y el 80.65% de los ácaros
no evidenció daños (ver Figura 5). Encontrando relación con lo hallado por
Araneda et al. (2010), quienes
reportaron en su estudio que el 49% de los ácaros colectadas utilizando este
tipo de trampa presentaron daños, mientras que el 51% de los ácaros no tenían
lesiones.
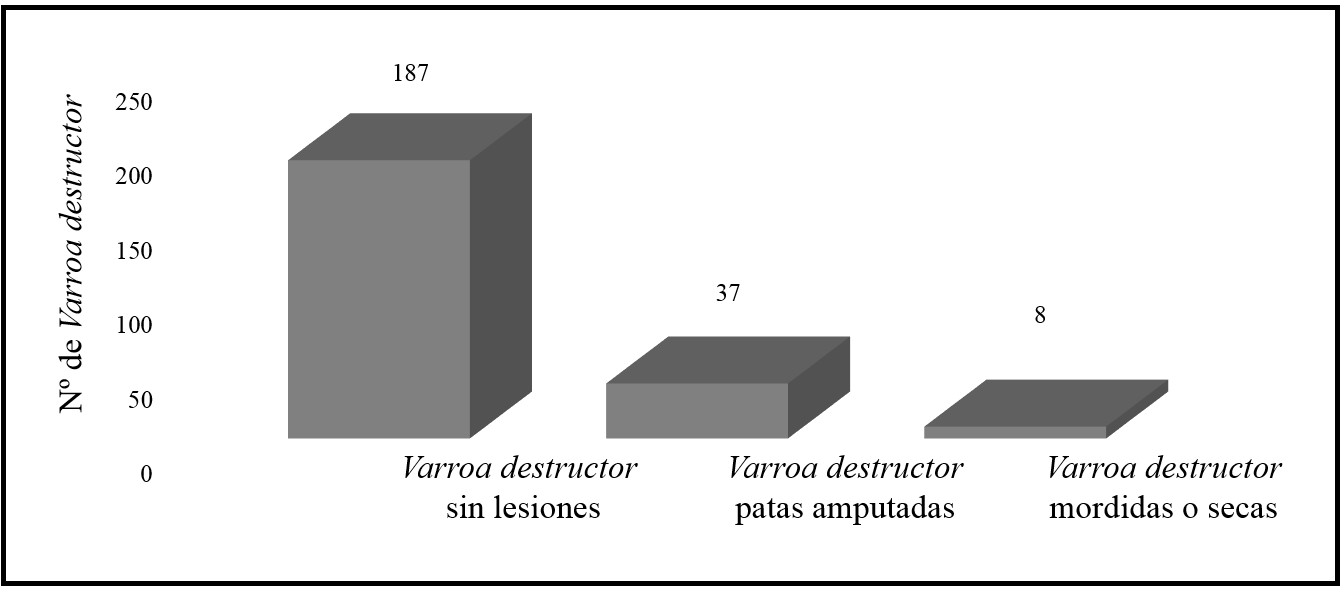 Figura 5
Individuos de V. destructor colectados en las
trampas de piso con y sin lesiones.
Elaboración
propia.
Figura 5
Individuos de V. destructor colectados en las
trampas de piso con y sin lesiones.
Elaboración
propia.
or otra parte, Guzman-Novoa et al. (2012) encontraron diferencias significativas entre el número de ácaros caídos por efecto del grooming y los genotipos evaluados, siendo las abejas africanizadas entre otras las que eliminaron más ácaros de sus cuerpos en comparación con las abejas europeas; teniendo las abejas africanizadas 7.8 veces más probabilidad de eliminar los ácaros que las abejas europeas. De igual forma, aseveran que la posibilidad de encontrar ácaros sin lesiones también es insumo para corroborar el comportamiento de grooming, pues las abejas despojan de su cuerpo el ácaro ya sea porque lo hacen con sus patas o mediante movimientos rápidos de sus cuerpos sin ocasionar daños al ectoparásito (Guzman-Novoa et al., 2012).
La lesión que se presentó con mayor frecuencia en adultos y ninfas fue la amputación de las patas, en los ácaros adultos con un 84.2% y en las ninfas con un 78.3%. Otras lesiones fueron cuerpo con mordida en un 9.6%, ácaros secos con 18.3% y ácaros con mordida en cuerpo y amputación de patas el 9.6% (ver Figura 6). Similar a lo reportado por Araneda et al. (2010) donde encontró que el daño en las extremidades fue de 37.1% mientras que los daños dorsales fueron del 11.2%, considerando este tipo de lesiones debidas al comportamiento de grooming de las abejas.
Sin embargo, en diversas regiones del mundo como Brasil, Sudáfrica, Rusia, Suecia, Francia y EE. UU, se ha encontrado que Apis mellifera ha presentado una adaptación de resistencia o al menos de tolerancia al ácaro (Locke, 2016). Además, las poblaciones del ácaro no solo dependen de su reproducción, sino de otros factores como la población de abejas, la reproducción y el estado sanitario de la colonia y las condiciones bióticas y abióticas que las influencian (Rosenkranz et al., 2010; Giacobino et al., 2017; Evans & Cook, 2018).
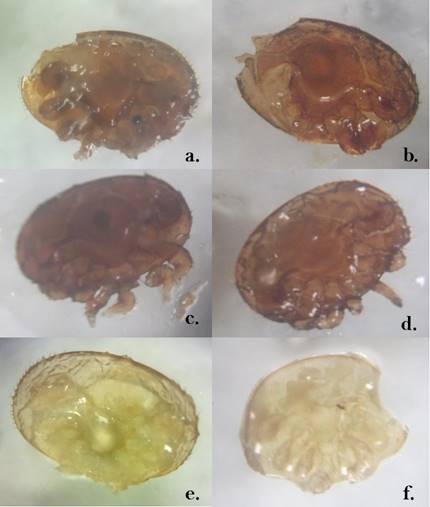 Figura 6
Lesiones causadas por las abejas en V. destructor: ácaros adultos con
mordidas (a, b), ácaros adultos con patas amputadas (c, d), ácaro adulto
disecado (e), ninfa mordida (f).
Elaboración propia.
Figura 6
Lesiones causadas por las abejas en V. destructor: ácaros adultos con
mordidas (a, b), ácaros adultos con patas amputadas (c, d), ácaro adulto
disecado (e), ninfa mordida (f).
Elaboración propia.
4. CONCLUSIONES
Estos resultados registran una
vez más como las abejas africanizadas han desarrollado comportamientos de
resistencia natural que les han permitido regular los niveles de infestación de
V.destructor en sus colonias y se convierte en un
valioso insumo para fortalecer programas de mejoramiento genético sostenibles,
que permitan tener colonias con mejores condiciones sanitarias y así evitar el
uso de acaricidas que comprometan la salud tanto de las colonias como de los
consumidores de los productos generados por las abejas.
Referencias
Anderson, D. L. & Trueman, J. W. H. (2000). Varroa jacobsonii (Acari: Varroidae) is more than one species. Experimental and Applied Acarology, 24(3), 165-189.
Araneda, X. D.; Bernales, M. M.; Solano, J. S. & Mansilla, K. V. (2010). Comportamiento de acicalamiento de abejas (Hymenoptera: Apidae) sobre Varroa destructor (Mesostigmata: Varroidae). Revista Colombiana de Entomologia, 36(2), 232-234.
Beyer, M.; Junk, J.; Eickermann, M.; Clermont, A.; Kraus, F.; Georges, C.; Reichart, A. & Hoffmann, L. (2018). Winter honey bee colony losses, Varroa destructor control strategies, and the role of weather conditions: Results from a survey among beekeepers. Veterinary Science, 118, 52-60. https://doi.org/10.1016/j.rvsc.2018.01.012
De Jong, D.; Roma, D. D. A. & Gon¸calves, L. S. (1982). A comparative analysis of shaking solutions for the detection of Varroa jacobsoni on adult honeybees. Apidologie, 13(3), 297-306. https://doi.org/10.1051/apido:19820308
De Miranda, J. R.; Cornman, R. S.; Evans, J. D.; Semberg, E.; Haddad, N.; Neumann, P. & Gauthier, L. (2015). Genome characterization, prevalence and distribution of a Macula-like virus from Apis mellifera and Varroa destructor. Viruses, 7(7), 3586-3602. https://doi.org/10.3390/v7072789
Evans, J. D. & Cook, S. C. (2018). Genetics and physiology of Varroa mites. Current Opinion in Insect Science, 26, 130-135. https://doi.org/10.1016/j.cois.2018.02.005
Giacobino, A.; Pacini, A.; Molineri, A.; Cagnolo, N. B.; Merke, J.; Orellano, E.; Bertozzi, E.; Masciangelo, G.; Pietronave, H. & Signorini, M. (2017). Environment or beekeeping management: What explains better the prevalence of honey bee colonies with high levels of Varroa destructor?. Veterinary Science, 112, 1-6. https://doi.org/10.1016/j.rvsc.2017.01.0012017
Guzman-Novoa, E.; Emsen, B.; Unger, P.; Espinosa-Montaño, L. G. & Petukhova, T. (2012). Genotypic variability and relationships between mite infestation levels, mite damage, grooming intensity, and removal of Varroa destructor mites in selected strains of worker honey bees (Apis mellifera L.). Journal of Invertebrate Pathology, 110(3), 314-320. https://doi.org/10.1016/j.jip.2012.03.020
Locke, B. (2016). Natural Varroa mite-surviving Apis mellifera honeybee populations. Apidologie, 47(3), 467-482. https://doi.org/10.1007/s13592-015-0412-8
Martin, S. J. & Medina, L. M. (2004). Africanized honeybees have unique tolerance to Varroa mites. Trends in Parasitology, 20(3), 109-112. https://doi.org/10.1016/j.pt.2003.12.005
Mondragón, L.; Spivak, M. & Vandame, R. (2005). A multifactorial study of the resistance of honeybees Apis mellifera to the mite Varroa destructor over one year in Mexico. Apidologie, 36(3), 345-358. https://doi.org/10.1051/apido
Moretto, G. & Leonidas, J. de M. (2003). Infestation and distribution of the mite Varroa destructor in colonies of africanized bees. Brazilian Journal of Biology, 63(1), 83-86.
Orantes-Bermejo, F. J.; Gómez Pajuelo, A.; Megías Megías, M. & Fernández-Píñar, C. T. (2010). Pesticide residues in beeswax and beebread samples collected from honey bee colonies (Apis mellifera L.) in Spain. Possible implications for bee losses. Journal of Apicultural Research, 49(3), 243-250. https://doi.org/10.3896/IBRA.1.49.3.03
Ratnieks, F. L. & Carreck, N. L. (2010). Carity on honey bee collapse? Science, 327(5962), 152-153. https://doi.org/10.1126/science.1185563
Ritter, W. (2001). Enfermedades de las abejas. Zaragoza: Acribia, S.A.
Rosenkranz, P.; Aumeier, P. & Ziegelmann, B. (2010). Biology and control of Varroa destructor. Journal of Invertebrate Pathology, 103, S96-S119. https://doi.org/10.1016/j.jip.2009.07.016
Salamanca Grosso, G.; Osorio Tangarife, M. P. & Rodríguez Arias, N. (2012). Presencia e incidencia forética de Varroa destructor A . (Mesostigma: Varroidae) en colonias de abejas Apis mellifera (Hymenoptera: Apidae), en Colombia. Zootecnia Tropical, 30(2), 183-195.
Sanford, M. T. (2006). Africanized honey bee: A biological revolution with human cultural implications. American Bee Journal.
Shen, M.; Yang, X.; Cox-Foster, D. & Cui, L. (2005). The role of varroa mites in infections of Kashmir bee virus (KBV) and deformed wing virus (DWV) in honey bees. Virology, 342(1), 141-149. https://doi.org/10.1016/j.virol.2005.07.012
Vandame, R.; Morand, S.; Colin, M. E. & Belzunces, L. P. (2007). Parasitism in the social bee Apis mellifera: quantifying costs and benefits of behavioral resistance to Varroa destructor mites. Apidologie, 33(5), 433-445. https://doi.org/10.1051/apido
Vieira, J.; Gonc¸alves, L. & De Jong, D. (2000). Africanized honey bees (Apis mellifera L.) are more efficient at removing worker brood artificially infested with the parasitic mite Varroa jacobsoni Oudemans than are Italian bees or Italian/Africanized hybrids. Genetics and Molecular Biology, 23(1), 89-92. https://doi.org/10.1590/S1415-47572000000100016










