INTRODUCCIÓN
Venezuela tiene una población y economía en crecimiento, con mejoras sustanciales en el sistema de salud pública, que generan una tendencia al envejecimiento de la población, así como una mayor incidencia de patologías relacionadas con la vejez. En este contexto, las patologías neoplásicas han adquirido una mayor incidencia en la población mundial, teniendo al cáncer de próstata, como una preocupación creciente en la epidemiología, ya que se diagnostican anualmente más de un millón de casos, que originan alrededor de 300.000 muertes por año.(1,2)
A lo largo de los años han sido múltiples los factores estudiados que pudieran aumentar el riesgo de padecer cáncer de próstata, teniendo en esta gama desde la alimentación y la actividad física hasta el cigarrillo y la herencia, sin embargo, la prevalencia de ellos varía de acuerdo al grupo poblacional estudiado. Recientemente se ha estudiado la asociación de polimorfismos en enzimas metabólica con múltiples patologías.(1)
Se ha determinado que en la población caucásica la actividad de la enzima Glutatión S-transferasa Mu 1 (GSTM1) y glutatión S-transferasa theta 1 (GSTT1) está ausente en aproximadamente el 50 y el 15% de los casos respectivamente, debido a la eliminación de ambas copias cromosómicas de los genes, la presencia de este genotipo nulo se ha asociado con un incremento del riesgo de múltiples neoplasias así como una mayor incidencia de hepatotoxicidad inducida por fármacos, cronificación de hepatitis viral, enfermedad vascular isquémica e hipertensión.(3-6)
Recientemente, varios estudios han evaluado la asociación de GSTM1 y GSTT1 con cáncer de próstata, sin embargo, se ha evidenciado una gran inconsistencia de los resultados.(7) Sin embargo, no existen datos específicos para la población venezolana, por lo cual se procede a la realización de este estudio comparando la expresión de polimorfismos positivos o nulos de las enzimas GSTT1 y GSTM1 en pacientes con cáncer de próstata y en pacientes con hiperplasia prostática benigna (HPB) no afectados de ningún tipo de cáncer.
MATERIALES Y MÉTODOS
Se realizó un estudio de tipo prospectivo, comparativo, abierto. Los pacientes fueron reclutados en el Servicio de Urología del Hospital Universitario de Caracas de la Universidad Central de Venezuela entre los meses de enero 2012 hasta diciembre 2013.
El protocolo fue presentado y aprobado al comité de ética del Hospital.
Población y Muestra
Los pacientes fueron reclutados en la consulta de Urología mayormente del área metropolitana de Caracas, Venezuela. El diagnóstico de los pacientes se basó en un examen que incluía tacto rectal, determinación de niveles de APS (antígeno prostático específico), examen de ultrasonido transrectal y biopsia. Los pacientes con elevación de APS y próstata hiperplásica al tacto, sin nódulos en la glándula fueron confirmados por ultrasonido transrectal como portadores de HPB. Los pacientes con APS elevado y glándulas nodulares fueron estudiados mediante biopsia.
Se incluyeron en la investigación a 100 pacientes, de los cuales 50 habían sido diagnosticados con adenocarcinoma de próstata y 50 con HPB como grupo control. El muestreo fue intencional, no probabilístico con una media de edad para el grupo con adenocarcinoma de próstata de 65,4 ± 7,31, y 65, 92 ± 7,31 para el grupo control.
Criterios de inclusión para el grupo de pacientes con cáncer de
próstata:
Adenocarcinoma prostático demostrado por biopsia.
Antígeno prostático específico por encima del límite superior de 4.
Criterios de inclusión para el grupo control:
Antígeno prostático específico elevado.
Tacto rectal con evidencia de aumento de volumen de la glándula.
Ultrasonograma transrectal negativo, sin evidencia de cáncer.
Criterios de Exclusión para el grupo control:
Pacientes menores de 40 y mayores de 80 años.
Padecer cualquier tipo de neoplasia maligna en la actualidad o como antecedente.
Negativa a otorgar el consentimiento informado por escrito para la participación en el estudio.
Criterios de Exclusión para el grupo de pacientes con Cáncer de
Próstata:
Pacientes menores de 40 y mayores de 80 años que no estén afectados por ningún tipo de cáncer.
Presencia de malignidades diferentes a adenocarcinoma prostático.
Negativa a otorgar el consentimiento informado para la participación en el estudio.
Procedimientos
Todos los pacientes firmaron una hoja de consentimiento informado en presencia de testigos, autorizando su participación en el estudio. Todos los pacientes completaron el cuestionario, que incluye factores de riesgo respecto a cáncer de próstata, así como datos relevantes de la Historia Médica.
Los cuestionarios fueron separados cada uno como control o cáncer de próstata y numerados consecutivamente. Los datos obtenidos fueron transcritos a una hoja de Excel® y se analizaron utilizando promedio, porcentaje, desviación estándar y chi cuadrado.
Análisis de Polimorfismos de
Glutatión S-Transferasas
Se realizó la extracción de 9 cc de sangre de la vena antecubital a cada paciente, repartidos en partes iguales en 3 tubos con EDTA como anticoagulante. La muestra de sangre fue utilizada para la determinación del genotipo de GSTT1, y GSTM1. Esta muestra fue mantenida a –20ºC hasta el momento de su procesamiento.
El ADN se aisló a partir de linfocitos utilizando un kit disponible comercialmente (QIAmp DNA Blood Midi and Maxi Kit, QIAGen GMBH®).
Se realizó la amplificación de los segmentos secuenciales que corresponden a las enzimas GSTT y GSTM mediante la reacción en cadena de polimerasa (PCR) por el método tradicional. La amplificación fue llevada a cabo simultáneamente y se obtuvieron fragmentos de 218 pb (pares de bases) y 459 pb. Posteriormente se realizó una electroforesis en gel con bromuro de etidio y los productos de amplificación de ADN se detectaron en un transiluminador bajo luz ultravioleta. Se documentaron fotográficamente los resultados.(8)
Se realizó el tratamiento estadístico adecuado de los mismos mediante el empleo de porcentaje y chi cuadrado.
RESULTADOS
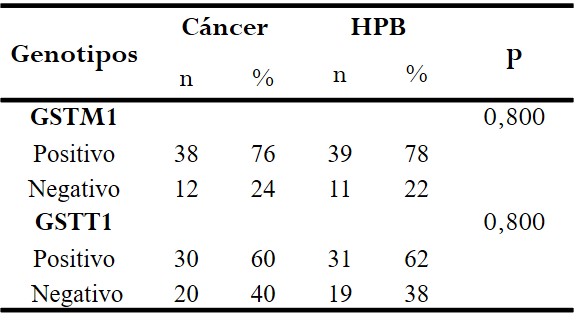
En
el análisis de los genotipos de las enzimas GSTs, en
el grupo de los pacientes con cáncer de próstata se observó el genotipo nulo
para GSTT1 en 20 pacientes (40 %) y genotipo nulo para GSTM1 en 12 pacientes
(24 %); mientras que en los pacientes con HPB se presentó el genotipo nulo de
GSTT1 en 19 (38 %) y para GSTM1 en 11 (22 %). (Tabla 1)
Tabla 1.
Relación de los genotipos de GSTM1 /
GSTT1 y cáncer de próstata.
 HPB:
Hiperplasia prostática benigna
HPB:
Hiperplasia prostática benigna
DISCUSIÓN
El cáncer de próstata es la neoplasia maligna más común entre los hombres en todo el mundo, y es la segunda causa principal de muerte por cáncer entre los hombres en los Estados Unidos. Según GLOBOCAN(2), en 2012 se reportaron 1,1 millones de nuevos casos y 307,000 muertes. El cáncer de próstata constituye la 6ta causa de mortalidad de la población venezolana, generando una tasa de mortalidad por edad de 29,16 por cada 100,000 habitantes.(9)
Según el boletín de incidencia y mortalidad de la sociedad anticancerosa de Venezuela para el año 2017, se reportó un incremento de 14% en el número de nuevos casos para esta neoplasia, así como un ascenso del 21% en el número de fallecidos por año, cifras alarmantes que despiertan el interés y la preocupación del gremio médico nacional por conocer las causas que conllevan a este incremento sustancial en la prevalencia de esta patología.(9)
No se conocen las razones del aumento de esta enfermedad, pero se han sugerido como causas la mayor esperanza de vida y las técnicas mejoradas de diagnóstico; los factores de riesgo ya establecidos son la edad avanzada, la raza, los antecedentes familiares positivos de cáncer de próstata y la dieta occidental sin embargo varios otros factores de riesgo, como la obesidad, la actividad física, la actividad sexual, el tabaquismo y la ocupación también se han asociado con el riesgo de cáncer de próstata, pero su papel dentro de la etiología del cáncer de próstata sigue siendo incierto.(2)
Al igual que otras neoplasias, el cáncer de próstata constituye una entidad multifactorial, en donde factores genéticos y ambientales generan una alteración de procesos fisiológicos, que conllevan a la génesis de la neoplasia.(3)
Varios genes polimórficos que codifican enzimas involucradas en la biotransformación de carcinógenos han sido estudiados como posibles modificadores de riesgo de cáncer de próstata como son los de las enzimas N-acetil transferasa, citocromo P-450 y glutatión–S-transferasa (GST) siendo estas últimas el objeto de nuestra investigación.(10,11)
Las GST son enzimas metabolizadoras de fase II implicadas en la desintoxicación de compuestos electrófilos nocivos tanto endógenos como exógenos, cuyo mecanismo de acción radica en la conjugación de glutatión a moléculas diana, generando moléculas menos reactivas y más solubles, facilitando su excreción del organismo, evitando así su acumulación y consecuente daño a la membrana celular, así como a fragmentos de ADN específicos.(12)
Se han descrito cuatro familias de GST: citosólica, mitocondrial, microsomal /asociada a la membrana y fosfomicina / glioxalasa. En humanos, hay 17 GSTs citosólicas diferentes, divididas en 7 clases (alfa, mu, omega, pi, sigma, theta y zeta) basadas en la similitud de secuencia y los genes de las diferentes clases se encuentran en siete cromosomas distintos.(13,14)
Existen múltiples variantes en los genes que codifican las familias de GST, es decir, GSTM1-5 y GSTT1-2. Tanto GSTM1 como GSTT1 tienen variantes de deleción que se producen a frecuencias relativamente altas en poblaciones humanas de diversos orígenes étnicos. Una eliminación homocigótica común del gen GSTM1 anula su actividad y conduce a un fenotipo no funcional. Del mismo modo, un polimorfismo de deleción en GSTT1 conduce a la falta de actividad enzimática.(14,15)
Han sido múltiples los estudios realizados para correlacionar la asociación entre un genotipo nulo de GSTM1 y GSTT1 con el incremento en el riesgo de cáncer de próstata, encontrándose diversos resultados que varían de una población a otra, teniendo así que en individuos residentes de Irán, India y Japón existe una diferencia significativa entre los pacientes y controles independientemente de la raza de los individuos, generando así un aumento del riesgo de padecer cáncer de próstata.(16-20)
Por su parte un estudio realizado en países del caribe encontró que solamente existe diferencia significativa en el subgrupo de población con descendencia africana, sin asociaciones en otros grupos poblacionales.(21)
Un estudio realizado en población caucásica residente de Viena demostró que no existe relación significativa entre pacientes y controles17, mientras que un metaanálisis realizado de 73 estudios entre los años 1999 y 2012 comparó la presencia de un genotipo nulo de la GSTT1 con el cáncer de próstata, evidenciándose que solamente existe un incremento del riesgo para cáncer de próstata en pacientes caucásicos con genotipo nulo, en el resto de la población general la presencia de un genotipo nulo no representó un riesgo significativo.(19, 20)
Otros autores por su parte han encontrado que la asociación significativa entre estas variables solo se evidencia en individuos de origen africano mientras que no se evidencia asociación entre europeos y euroasiáticos.(22)
Se ha correlacionado la asociación por separado de la GSTT1 y GSTM1, encontrando resultados diversos, en algunos incrementos del riesgo mientras en otros no, por lo cual esta serie de resultados, nos permite evidenciar que la expresión y asociación entre estas enzimas metabólicas y el cáncer de próstata varia de una población a otra, por lo cual es necesario seguir comparando estas variables con una muestra mayor para concluir el patrón en la población venezolana.(22,23)
En el estudio no se evidencian diferencias significativas entre los casos y controles para genotipo nulo GSTT1 y GSTM1, expresando así el genotipo de la población venezolana con cáncer de próstata desconocido hasta el momento, uno de las razones que pudiera explicar nuestro patrón es el tamaño reducido de la muestra estudiado.
CONCLUSIÓN
Es
conocida la asociación entre polimorfismos en genes que codifican para enzimas
metabolizadoras como la GST con distintos tipos de neoplasias, sin embargo, con
respecto al cáncer de próstata existen resultados controversiales en los distintos
grupos poblacionales. En la muestra no se evidencian diferencias significativas
entre los casos y controles para genotipo nulo GSTT1 y GSTM1, expresando así el
genotipo de la población venezolana con cáncer de próstata desconocido hasta el
momento.
REFERENCIAS
1. Castillo A, Miranda C. Boletín de incidencia y mortalidad del cáncer basado en los datos del informe pronósticos de la mortalidad e incidencia de cáncer en Venezuela en el año 2016. Sociedad anticancerosa de Venezuela; 2017.
2. CancerVenezuela.com (Internet). Caracas: Sociedad Venezolana anticancerosa; 2016 (citado 2018 Mayo 27). Disponible en: https://www.cancervenezuela.org/descargas/boletin-incidencia-mortalidad-cancer-informe-pronosticos-mortalidad-venezuela-2016.pdf
3. Naeem M, Epidemiology of Prostate Cancer. Asian Pac J Cancer. 2016; DOI: http://dx.doi.org/10.7314/APJCP.2015.16.13.5137
4. Franklin M. Phase II Biotransformation Reactions-Glutathione-S-Transferase. xPharm: The Comprehensive Pharmacology Reference. 2007; DOI: https://doi.org/10.1016/B978-008055232-3.60284-3
5. Agúndez JA, Ladero JM. Glutathione S-transferase GSTT1 and GSTM1 allozymes: beyond null alleles. Pharmacogenomics. 2008; DOI: 10.2217/14622416.9.3.359.
6. Setiawan VW, Zhang ZF, Yu GP, Li Yl, Lu Ml, Tsai CJ, et al. GSTT1 and GSTM1 null genotypes and the risk of gastric cancer: a case-control study in a Chinese population. Cancer Epidemiol Biomarkers Prev. 2000; 9(1): 73-80.
7. Cooperberg M, Chan J. Epidemiology of prostate cáncer. World J Urol. 2017; DOI 10.1007/s00345-017-2038-0
8. Tang Q, Li J, Zhang S. GSTM1 and GSTT1 Null Polymorphisms and Childhood Acute Leukemia Risk: Evidence from 26 Case-Control Studies. PLoS One. 2013; DOI: 10.1371/journal.pone.0078810.
9. Angerer J, Müller M. Glutathione S-Transferase T1 and M1 (GSTT1, GSTM1) (genotyping) pp 181-210. Deutsche: Forschunggemeinschaft; 2004.
10. Safarinejad M, Shafiei N, Safarinejad S. Glutathione S-transferase gene polymorphisms (GSTM1, GSTT1, GSTP1) and prostate cancer: a case-control study in Tehran, Iran. Prostate Cancer and Prostatic Diseases. 2014; 14(1): 105-113.
11. Reszka E, Wasowicz W. Genetic polymorphism of N-acetyltransferase and glutathione S-transferase related to neoplasm of genitourinary system. Neoplasma. 2002; 49:209-216.
12. Bachmann K. Drug Metabolism: Pharmacology Principles and Practice 2009. California: USA, Elsevier; 2009.
13. Nebert D, Vasiliou V. Analysis of the glutathione S-transferase (GST) gene family. Hum Genomics. 2004; DOI: 10.1186/1479-7364-1-6-460
14. Modem O, Mannervik B. Glutathione Transferases in the Bioactivation of Azathioprine. Advances in Cancer Research. 2014; DOI: https://doi.org/10.1016/B978-0-12-420117-0.00006-2
15. Shakil S, Masood N, Azra Y. Prostate cancer and glutathione S-transferase deletions. EXCLI J. 2015; DOI: 10.17179/excli2015-192
16. Lal Srivastava D, Mandhani A, Mittal B. Genetic polymorphism of glutathione S‐transferase genes (GSTM1, GSTT1 and GSTP1) and susceptibility to prostate cancer in Northern India. BJUI. 2004; DOI: https://doi.org/10.1111/j.1464-410X.2005.05271.x
17. Murata M, Shiraishi T Fukutome K, Masatoshi W, Minako N, Yoshinobu K, et al. Cytochrome P4501A1 and Glutathione S-Transferase M1 Genotypes as Risk Factors for Prostate Cancer in Japan Japanese Journal of Clinical Oncology. 1998; DOI: https://doi.org/10.1093/jjco/28.11.657
18. Gsur A, Haidinger G Hinteregger S, Bernhofer G, Schatzl G, Madersbacher S, et al.
Polymorphisms of glutathione‐S‐transferase genes (GSTP1, GSTM1 and GSTT1) and
prostate‐cancer risk. IJC. 2001; DOI: https://doi.org/10.1002/1097-0215(20010520)95:3<152::AID-IJC1026>3.0.CO;2-S
19. Biao Zhou T, Drummen G, Pei Jiang Z. GSTT1 Polymorphism and the Risk of Developing Prostate Cancer American Journal of Epidemiology. 2014; DOI: https://doi.org/10.1093/aje/kwu112
20. Liu D, Liu Y, Ran L, Qin Y. GSTT1 and GSTM1 polymorphisms and prostate cancer risk in Asians: a systematic review and meta-analysis. Tumour Biol. 2013; DOI: 10.1007/s13277-013-0778-z
21. Emeville E, Broquère C, Brureau L, Séverine F, Blanchet P, Multigner L, et al. Copy number variation of GSTT1 and GSTM1 and the risk of prostate cancer in a Caribbean population of African descent. PLoS One. 2014; DOI: 10.1371/journal.pone.0107275.
22. Malik SS, Kazmi Z, Fatima I, , Perveen S, Masood N. Genetic Polymorphism of GSTM1 and GSTT1 and Risk of Prostatic Carcinoma - a Meta-analysis of 7,281 Prostate Cancer Cases and 9,082 Healthy Controls. Asian Pac J Cancer Prev. 2016; 17(5):2629-35.
23. Mo Z, Gao Y, Cao Y, Gao F, Jian L.An updating meta-analysis of the GSTM1, GSTT1, and GSTP1 polymorphisms and prostate cancer: a HuGE review. Prostate. 2009; DOI:10.1002/pros.20907.
Información adicional
Agradecimientos: Nos complace agradecer al Consejo de
Desarrollo Científico y Humanístico de la Universidad Central de Venezuela por
brindar colaboración parcial para la realización de este trabajo.
Conflicto
de intereses: Los
autores declaran no tener ningún tipo de conflicto de intereses, ni ninguna
relación económica, personal, política, interés financiero ni académico que
pueda influir en su juicio. Declaran, además, no haber recibido ningún
tipo de beneficio monetario, bienes ni subsidios de alguna fuente que pudiera
tener interés en los resultados de esta investigación.
Cómo citar: Angeli-Greaves M, Garate J, Pérez-Pereda MG, Viera E, Yibirin M, Harrison S, et al. Cáncer de próstata y polimorfismos de la glutation s-transferasa en una población venezolana. Rev Digit Postgrado.2019; 8(2):e161.





