Resumen: La creciente emergencia de las enfermedades infecciosas y el aumento del número de individuos que tienen afectada su competencia inmunológica se ha convertido en un reto. Por otro lado, considerando el género Aspergillus, como un agente etiológico de infección, causa importante de morbilidad y mortalidad en pacientes inmunocomprometidos. Presentamos el caso de preescolar femenino de 3 años y 8 meses con antecedente de teratoma maduro fetiforme, quien posterior a 6 meses de su exéresis, se realiza tomografía axial computarizada (TAC) de Tórax control evidenciándose bronquiectasias centrales con opacidades tubulares y saculares de distribución bronquial, con localización principalmente en lóbulo superior de hemitórax izquierdo, disminución del volumen pulmonar ipsilateral con incipiente desplazamiento del cardiomediastino a la izquierda y escaso derrame pleural izquierdo, examen físico sin alteraciones, por lo que ingresa con diagnóstico de enfermedad granulomatosa en estudio. Se realiza detección de antígeno galactomanano que reporta positivo en dos determinaciones por lo que se replantea el diagnóstico a Aspergilosis Pulmonar Invasiva, cumple tratamiento con voriconazol por 21 días, con mejoría significativa de las lesiones pulmonares en TAC de tórax, egresando con tratamiento con itraconazol a cumplir por 6 semanas. El inicio precoz del tratamiento constituye un factor pronóstico fundamental de la aspergilosis invasiva, siendo el voriconazol la primera línea.
Palabras clave: Aspergilosis, inmunidad, enfermedad pulmonar y pediatría.
Abstract: The growing emergence of infectious diseases and increasing the number of individuals that have affected their immune competence has become a challenge. Furthermore, considering the genus Aspergillus, as an etiologic agent of infection, which causes significant morbidity and mortality in immunocompromised patients. We present a case of a female preschool 3 years and 8 months with a history of mature teratoma fetiforme, who after 6 months of excision, computed tomography (CT) scan control is performed where central bronchiectasis are evident with tubular opacities and saculares bronchial distribution, located mainly in the upper lobe of left chest, decreased left lung volume with incipient displacement of the heart and medistino left and low left pleural effusion, physical examination no alterations to income, so you enter with diagnosis of granulomatous disease study. antigen detection galactomannan reporting positive in two determinations so the diagnosis of invasive pulmonary aspergillosis rethinks meets voriconazole for 21 days, with significant improvement of lung lesions in chest CT scan, graduating with itraconazole therapy is performed to meet for 6 weeks. The early initiation of treatment is a fundamental prognostic factor of invasive aspergillosis, constituting the first line in voriconazole.
Keywords: Aspergillosis, Immunity, Pulmonary disease, pediatric.
Caso Clínico
Aspergilosis pulmonar invasiva en paciente pediátrico
Invasive pulmonary aspergillosis in a pediatric patient
Recepción: 29 Noviembre 2020
Aprobación: 14 Mayo 2021

La creciente emergencia de las enfermedades infecciosas y el aumento del número de individuos que tienen afectada su competencia inmunológica, significan un enorme reto para aquellos profesionales que se dedican a tratarlas y a erradicarlas.(1)
Considerado hasta el momento como una etiología inusual de infección, el género Aspergillus se ha revelado como una causa importante de morbilidad y mortalidad en pacientes inmunocomprometidos. La Aspergilosis Invasiva constituye la causa más frecuente de mortalidad por neumonía infecciosa en pacientes sometidos a trasplante alogénico de células madre hematopoyéticas (TCMH) y una causa importante de infección diseminada e incluso infección respiratoria oportunista en pacientes inmunocomprometidos. Otras formas de aspergilosis, como aspergilosis broncopulmonar alérgica, la sinusitis alérgica y la infección saprofítica, también son causas de morbilidad y rara vez son potencialmente mortales.(2)
Preescolar femenina de 3 años y 8 meses referido del Servicio de Pediatría Medica Infecciosa del Hospital Universitario de Caracas (HUC), con antecedente de Teratoma Maduro Fetiforme, en quien se realiza Tomografía axial Computarizada (TAC) de Tórax, abdomen y pelvis el 07/10/2015, correspondiente a su control postquirúrgico, se evidencia disminución del volumen pulmonar izquierdo con incipiente desplazamiento del cardiomediastino a la izquierda, por lo cual es evaluado e ingresado en el servicio de pediatría médica.
Producto de madre de 20 años, II Gesta, II Parto, embarazo no planificado, deseado y controlado desde el tercer mes de gestación, ecosonogramas dentro de límites normales. Obtenido a las 38 semanas por parto eutócico simple, sin complicaciones. Presentando peso al nacer de 3300 gramos y talla al nacer de 52 centímetros. Desarrollo psicomotor acorde a edad. Madre refiere diagnóstico de lesión ocupante de espacio abdominal el 07/03/15, por lo cual se realiza en el Hospital Felipe Guevara Rojas de la ciudad del Tigre, del estado Anzoátegui, laparotomía exploratoria para biopsia que reporta teratoma quístico benigno, por lo que es referida al HUC, donde realizan exeresis total, extrayendo pieza de 17.5 cm x 13 x 10 cm, con peso de 800 gr, reporte anatomopatológico de TERATOMA MADURO FETIFORME (HOMUNCULO) con los siguientes componentes: piel con quistes de contenido queratinico laminar, tejido óseo, cartílago maduro, mucosa intestinal, tejido adiposo y nervio periférico. No se observó tejido nervioso inmaduro u otro componente germinal maligno. Actualmente en control por el servicio de Oncología Pediátrica del HUC.
En cuanto a los antecedentes epidemiológicos refiere vivienda en área rural del estado Anzoátegui, con paredes de bloques sin frisar, con piso de cemento pulido y techo de platabanda. Refiere construcciones peridomiciliarias, niega fumadores y tosedores crónicos intradomicialiarios.
Examen físico de ingreso, presenta un peso de 13.300 gr, talla de 96 cm y circunferencia cefálica de 47 cm, con percentiles antropométricos adecuados para la edad (p15-50), frecuencia cardiaca 114 lpm, frecuencia respiratoria 24 rpm, saturación por oximetría de pulso: 99 % aire/ambiente. Paciente en estables condiciones generales, afebril, sin signos de dificultad respiratoria, tórax simétrico, normoexpansible, ruidos respiratorios presentes, sin agregados a la auscultación, ruidos cardiacos rítmicos y regulares, abdomen se evidencia cicatriz eutrófica hipercrómica, sin signos de flogosis, de 16 cm de longitud, desde flanco derecho a flanco izquierdo, neurológico activa, con buena respuesta a estímulos externos, no focalización, ni signos meníngeos.
Estudios imagenológicos realizados, TAC de tórax, abdomen y pelvis control del 07/10/16, donde se evidencian bronquiectasias centrales con opacidades tubulares y saculares de distribución bronquial, con localización principalmente en el lóbulo superior de hemitórax izquierdo, disminución del volumen pulmonar izquierdo con incipiente desplazamiento del cardiomediastino a la izquierda y escaso derrame pleural izquierdo. (Figura 1) Además disminución del tamaño renal derecho con exclusión del funcionalismo renal, ante lo mencionado se ingresa con diagnóstico de Enfermedad Granulomatosa en estudio.
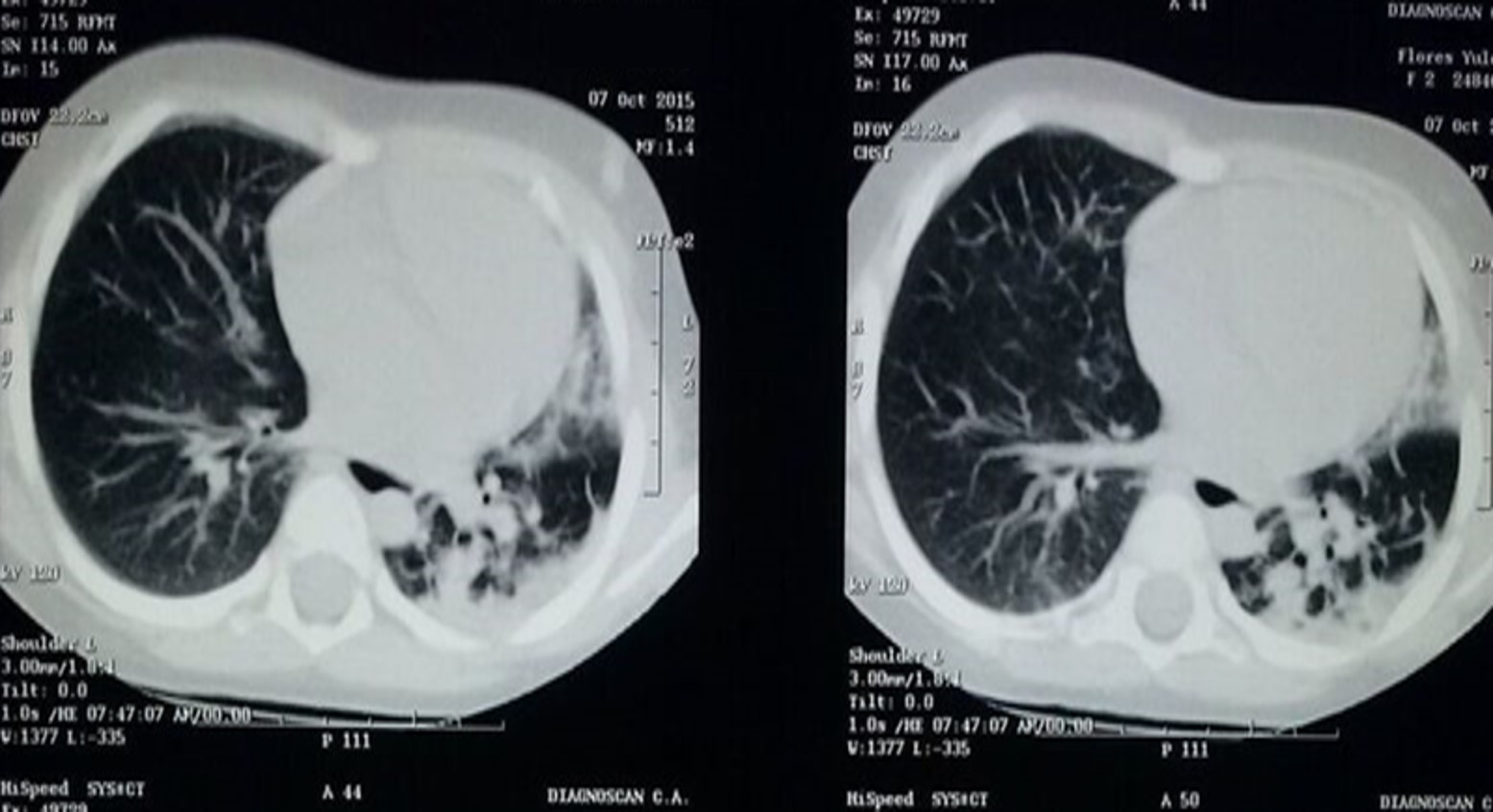
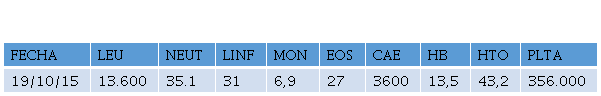
Paraclínicos de ingreso reportan leucocitosis con eosinoflia severa, Glóbulos Blancos 13.600 uL, Neutrófilos 35.1 %, Linfocitos 31 %, Monocitos 6.9 %, eosinófilos 27 %, CAE: 3.600, Hemoglobina 13,5 gr/dl, Hematocrito 43,4 %, plaquetas 356.000, PCR 0,2 gr/dl, VSG 6 mm, serologías Virus de Inmunodeficiencia Humana negativo y VDRL no reactivo. (Tabla 1).
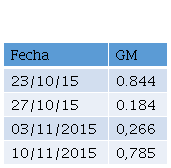
Serologías de micosis profundas Histoplasmina y Paracoccidiodina, PPD, BK en contenido gástrico negativos, Primera determinación de Galactomanano, con reporte de 0.844, (valor de referencia 0.5 para considerar positivo), se replantea diagnóstico a Aspergilosis Pulmonar Invasiva, iniciando tratamiento con voriconazol (6 mg/kg/día) que cumple por 2 dosis y luego voriconazol (3 mg/kg/día). Se realiza curva de detección de Galactomanano observándose dos resultados positivos por encima del valor de referencia (Tabla 2).
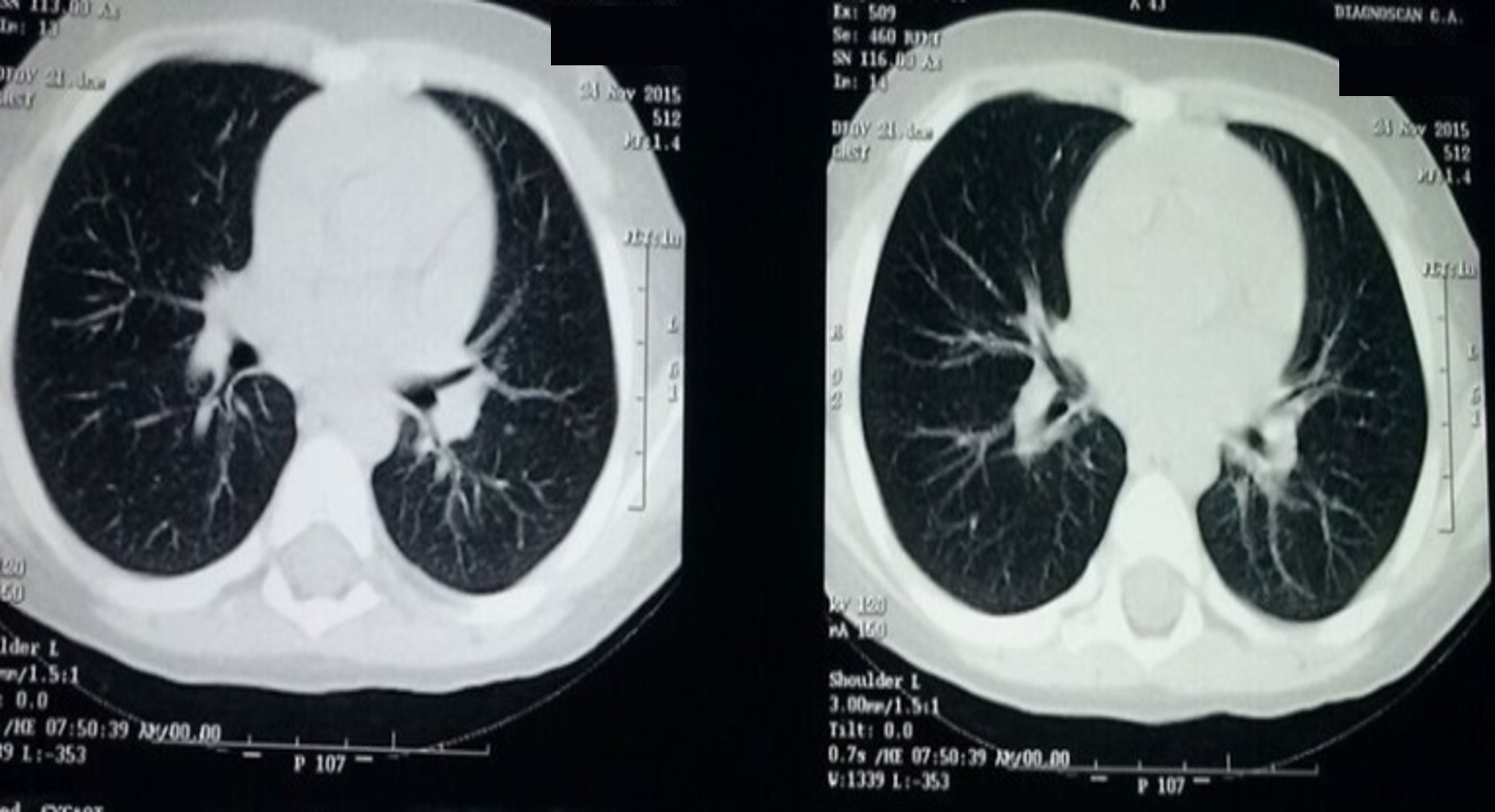
Al cumplir 21 días de tratamiento con voriconazol, se realiza TAC de tórax control y se observa disminución de bronquiectasias pulmonares izquierdas, resolución de derrame pleural izquierdo, exclusión renal derecha (Figura 2). Egresa en estables condiciones generales, sin alteraciones al examen físico, con tratamiento ambulatorio con itraconazol (8 mg/kg/día), vía oral, por 8 semanas y controles por servicio de Infectología y Neumología Pediátrica.
La Aspergilosis Pulmonar es una infección fúngica causada por el hongo Aspergillus, en la mayoría de los casos de la especie A. fumigatus, un hongo ubicuo que se adquiere inhalando sus esporas. La inhalación ocurre habitualmente en la población, por lo que aislar el hongo en el esputo no necesariamente implica una invasión o síntoma.(3)
La Aspergilosis pulmonar se produce como consecuencia de la inhalación de esporas contenidas en el aire que se encuentra principalmente en materia orgánica y humedad, es por ello que los senos paranasales y los pulmones son los sitios en los que se asienta primariamente la enfermedad con mayor frecuencia.(4)
El hecho de contraer esta enfermedad depende de la susceptibilidad del huésped, principalmente en aquellos que poseen una marcada neutropenia o neutrófilos con funcionalidad deficiente, por lo tanto los individuos más susceptibles son los pacientes con enfermedades neoplásicas, granulocitopenia y terapia con esteroides sistémicos. La patogenicidad está relacionada con el pequeño tamaño de las conidias, 2-5 μm, que al ser inhaladas ingresan a los espacios alveolares. Cuando el hongo es capaz de invadir las mucosas, se activa la respuesta del huésped mediada por células del sistema inmune innato (células dendríticas, monocitos, neutrófilos).
En los neutrófilos, el proceso de oxidación más destacado es el mediado por la enzima NADPH-oxidasa, cuando se activa, se producen reacciones en cadena que finalizan formando radicales libres con capacidad antimicrobiana. La carencia de esta enzima, se asocia a elevado riesgo de padecer aspergilosis invasiva. Los neutrófilos tienen mayor capacidad para eliminar complejos conidia-pentraxina 3. La pentraxina 3 es secretada por macrófagos y células epiteliales durante la infección por Aspergillus, se une al galactomanano y causa fijación de las conidias.(5)
La Aspergilosis Angioinvasiva se caracteriza por la invasión de arterias pulmonares pequeñas y medianas por las hifas de Aspergillus que producen una trombosis con isquemia, necrosis tisular y, finalmente diseminación hematógena sistémica. Estos infartos hemorrágicos se observan en la TAC como pequeños nódulos y/o consolidaciones periféricas en forma de cuña, rodeadas por un halo de aumento de atenuación en vidrio deslustrado. Este anillo periférico en vidrio deslustrado representa la hemorragia alveolar que acompaña a un foco de necrosis isquémica coagulativa y se conoce como «signo del halo» este signo no tiene implicación pronóstica ni es patognomónico de la aspergilosis invasiva.(6)
El signo del halo puede observarse en un amplio espectro de enfermedades pulmonares: Granulomatosis de Wegener, neumonía eosinofílica, neumonía organizada criptogenética, infecciones (Herpes simples, Mycobacterium avium complex o Candida), neoplasias primarias (sarcoma de Kaposi, adenocarcinoma o linfoma) y metástasis de tumores hipervasculares (Angiosarcoma, Coriocarcinoma y Osteosarcoma).(7)
Desde hace 20 años se conoce la presencia de más de 100 componentes antigénicos en el suero de enfermos con Aspergilosis Invasiva (AI), siendo el marcador de mayor utilidad diagnóstica el Galactomanano (GM).(8)
El GM es un componente de la pared celular del género Aspergillus, siendo el principal exoantígeno liberado durante la angioinvasión. En enfermos con aspergilosis invasiva el GM puede ser detectado en suero, orina, líquido cefalorraquídeo, líquido pericárdico y pleural.(9) Tiene una sensibilidad de 71% y una especificidad de 89%, con un valor predictivo positivo entre 25% y 62% y un valor predictivo negativo entre 92% y 98%, aunque con gran variabilidad entre los diferentes estudios.(10)
El GM positivo se considera cuando se obtienen al menos dos determinaciones consecutivas positivas, siendo el punto de corte inicialmente recomendado en suero de 1,5 ng/ml, actualmente en Europa se ha fijado el punto de corte en 1 ng/ml, mientras que en EE.UU, se recomienda utilizar 0,5 ng/ml. El GM es de gran utilidad diagnóstica en pacientes neutropénicos adultos (menor de 100 N/mm3 en más de 3 semanas ó menor de 500 N/mm3 en más de 5 semanas), catalogados como de alto riesgo de desarrollar una aspergillosis invasiva. El GM es de dudosa utilidad diagnóstica en la población pediátrica, receptor de trasplante de órgano sólido, SIDA, enfermedad granulomatosa crónica, neoplasias de órgano sólido y pacientes con grandes quemaduras.(11)
La precocidad del inicio de tratamiento es un factor pronóstico fundamental de la aspergilosis invasiva; El voriconazol es el tratamiento de elección de primera línea, (en un estudio aleatorizado de Thomas en el 2008), comparado con anfotericina B deoxicolato. Siendo la dosis de ataque de 6 mg/kg/día, vía endovenosa, cada 12 h por 2 dosis, seguidas de 4 mg/kg cada 12 h. Dosificaciones mayores que las administradas habitualmente para el tratamiento oral (200 mg, cada 12 horas), es posible acercar el tratamiento oral a la dosificación estándar con 4 mg/kg/dosis redondeada la dosis adecuada de los comprimidos, aunque el empleo de voriconazol oral en estas dosis se encuentra en fase de investigación y no se ha estudiado en forma exhaustiva.(2)
La literatura reporta que radiológicamente el hallazgo clásico del signo del halo es poco frecuente en los pacientes con Aspergilosis Pulmonar Invasiva (API); y es más prevalente ver infiltrados pulmonares, densidades basales pleurales o cavernas. Un estudio en pacientes trasplantados de órganos sólidos con API reporta que ninguno de los pacientes presentó el signo del halo y eran más frecuentes la presencia de signos inespecíficos.(12,13) La escanografía es una ayuda que brinda mayor información del compromiso pulmonar, siendo frecuentes la presencia de nódulos menores a 1 cm y masas con centros de densidades bajas o cercanas a la densidad del aire (14). Sin embargo, La broncoscopia flexible (BF) con LBA, es la piedra angular para la detección microbiológica del Aspergillus spp, primordialmente en casos de consolidaciones, patrón de árbol en gemación y en infiltraciones pulmonares.(15) La broncoscopia flexible con BAL conserva un papel en la manejo de pacientes inmunodeprimidos que presentan infiltrados pulmonares especialmente en el establecimiento de diagnóstico microbiológico confirmado. Un diagnóstico es posible en el 60,8% y las complicaciones son en gran medida autolimitadas.(16)
Con relación al diagnóstico de la paciente y lo reportado en TAC de tórax, a pesar que no es patognomónico ningún hallazgo en este tipo de estudio, se estableció la curva de valores de determinaciones de galactomanano evidenciándose la positividad de al menos 2 valores como lo establecidos en literaturas consultadas. Siendo así el marcador de utilidad diagnóstica para aspergilosis invasiva. Por otro lado, el inicio del tratamiento con antifúngicos de primera línea como el voriconazol, marcó un excelente pronóstico al no afectar la función pulmonar, lo cual se puede evidenciar hasta la actualidad en sus controles clínicos y paraclínicos.
Cómo citar: Planchet J, García R, González Z, Mendoza A. Aspergilosis
pulmonar invasiva en paciente pediátrico. Rev Digit Postgrado. 2021;10(3): e324. doi:
10.37910/RDP.2021.10.3.e324
Conflicto de interés: los
autores declaran no tener conflicto de interés.





