



Artículo Original
Niveles séricos de interleucina-6 en pacientes con diabetes tipo 2 y su correlación con el perfil lipídico
Serum levels of interleukin-6 in patients with type 2 diabetes and its correlation with the lipid profile
Revista Digital de Postgrado
Universidad Central de Venezuela, Venezuela
ISSN-e: 2244-761X
Periodicidad: Semestral
vol. 10, núm. 2, e309, 2021
Recepción: 02 Diciembre 2020
Aprobación: 03 Marzo 2021

Cómo citar: Escalera J, Pérez L, Brito S, Lares M, Flores L, Castro J. Niveles séricos de interleucina-6 en pacientes con diabetes tipo 2 y su correlación con el perfil lipídico. Rev Digit Postgrado. 2021;10(2): e309. doi: 10.37910/RDP.2021.10.2.e309
Resumen: La diabetes mellitus es una enfermedad metabólica caracterizada por hiperglucemia, a consecuencia de defectos en la producción, secreción y/o acción de la insulina, produciendo alteraciones en el metabolismo de los hidratos de carbono, lípidos y proteínas; asociado a un proceso inflamatorio crónica en un plazo variable, que provocara lesiones macro y microvasculares. Objetivo: Evaluar los niveles séricos de interleucina-6 (IL-6) en pacientes diabéticos tipo 2 y su correlación con el perfil lipídico. Métodos: Se realizó estudio descriptivo analítico y transversal, comprendido por 60 adultos de ambos sexos entre 30 a 60 años, con diabetes mellitus tipo 2 que acudieron a consulta de Endocrinología del Hospital Militar Universitario Dr. Carlos Arvelo. Se les determino glucemia basal, interleucina-6, perfil lipídico, resultados relacionados con parámetros antropométricos, composición corporal, la edad y tiempo de evolución de la diabetes. Resultados: La edad promedio de 51,60 años ± 6,51, donde el 71,6% correspondieron al sexo femenino y el 28,3% al masculino, tiempo de evolución de la diabetes entre 1 mes y 37 años, con un promedio de 10,97 años. Se presentó correlación positiva baja y estadísticamente significativa entre interleucina 6 y los parámetros de triglicéridos, VLDL y no-HDL Conclusión: Se encontró valores elevados de IL-6 en todos los pacientes diabéticos tipo 2, así como una correlación positiva entre IL-6 y las lipoproteínas ricas en triglicéridos. Esto respalda la idea de que la hipertrigliceridemia puede causar cambios inflamatorios en pacientes diabéticos y esto elevaría el riesgo cardiovascular de estos pacientes.
Palabras clave: interleucina-6, perfil lipídico, diabetes mellitus tipo 2.
Abstract: Diabetes mellitus is a metabolic disease characterized by hyperglycemia, because of defects in the production, secretion and / or action of insulin, producing alterations in the metabolism of carbohydrates, lipids and proteins; associated with a process of chronic inflation in a variable period, it will cause macro and microvascular lesions. Objective: Evaluate serum levels of interleukin-6 (IL-6) in type 2 diabetic patients and their correlation with lipid profile. Methods: An analytical and cross-sectional descriptive study was carried out, including 60 adults of both sexes between the age of 30 and 60, with type 2 diabetes mellitus who attended the Endocrinology consultation of the Hospital Militar Universitario Dr. Carlos Arvelo. Basal blood glucose, interleucine-6, lipid profile, and anthropometric parameters, body composition, age, and time of evolution of diabetes, was determined. Results: The average age of 51.60 years ± 6.51, where 71.6% corresponded to the female sex and 28.3% to the male, diabetes evolution time between a month and 37 years, with an average of 10.97 years. A statistically significant low positive correlation between interleukin-6 and triglyceride, VLDL and non-HDL parameters was presented. Conclusion: Elevated IL-6 values were found in all type 2 diabetic patients, as well as a positive correlation between IL-6 and triglyceride-rich lipoproteins. This supports the idea that hypertriglyceridemia can cause inflammatory changes in diabetic patients and this would raise the cardiovascular risk of these patients.
Keywords: interleucine-6, lipid profile, type 2 diabetes mellitus.
INTRODUCCIÓN
La diabetes mellitus (DM) es un desorden metabólico con gran incidencia mundial, del que se ha registrado un incremento en la última década en Latinoamérica. En las Américas se estimó una prevalencia de 9,4% y se calculó 31,6 millones de personas con diabetes para año 2019, siendo las proyecciones para 2030 de 40 millones de diabéticos en estas regiones. En Venezuela el estudio de salud cardiometabólica (EVESCAN) reporta para el 2017 prevalencia de diabetes mellitus tipo 2 de 13,1%(1) observándose un aumento con respecto a lo reportado en el 2008 por el Estudio CARMELA(2), donde se reporta una prevalencia del 6%.
La diabetes mellitus es una enfermedad sistémica, crónico-degenerativa de carácter heterogéneo con grados variables de predisposición hereditaria y con la participación de diversos factores ambientales. Se caracteriza por hiperglucemia crónica debido a la deficiencia en la producción o acción de la insulina, con efectos sobre el metabolismo intermedio de carbohidratos, lípidos y proteínas(3). La patogenia de la resistencia a la insulina y la diabetes mellitus tipo 2 (DMT2) se ha asociado con una inflamación crónica subclínica y la activación del sistema inmunológico; sin embargo, aún no está claro qué desencadena esta inflamación(4,5).
Algunos estudios han demostrado que pacientes con DMT2, tienen niveles más altos de marcadores inflamatorios como la interleucina-6 (IL-6), proteína C reactiva (PCR), el inhibidor del activador del plasminógeno-1 (PAI-1), el factor de necrosis tumoral-α (TNF-α), molécula de adhesión celular vascular-1 (VCAM-1), y molécula de adhesión intercelular-1 (ICAM-1)(6,7). La interleucina-6 es una citoquina pleiotrópica, producida por los adipocitos, fibroblastos, células endoteliales, los leucocitos y monocitos activados. Es un regulador principal de fase aguda en la respuesta inflamatoria, y ejerce diferentes efectos en una amplia gama de células, actuando en la hematopoyesis, el sistema nervioso central y la defensa del huésped(8-10). Asimismo, la IL-6 actúa sobre el tejido adiposo y el músculo esquelético como una adipocina que modula el metabolismo de los lípidos, la hemostasia, la presión arterial y el metabolismo de la glucosa, e influye en la aterosclerosis(11).
Recientes estudios, indican que individuos con DMT2 los niveles más altos de marcadores proinflamatorios están asociados con la formación de placa aterosclerótica y la disfunción endotelial(12,13) y este proceso inflamatorio puede acelerar el desarrollo de complicaciones microvasculares(14), donde la interleucina-6, desempeña un papel importante en el inicio y la aceleración de la inflamación crónica y contribuyendo a las complicaciones microvasculares de estos en pacientes(12). Adicionalmente se ha observado que estos marcadores proinflamatorios, se encuentran incrementados en aquellos pacientes con DMT2 obesos (con un IMC > 30 kg/m2) en comparación con pacientes DMT2 no obesos y controles obesos(15,16). Aproximadamente un 80% de los sujetos con DMT2 y exceso de grasa abdominal presentan insulinoresistencia, y éste parece ser el mecanismo clave de la presencia de dislipidemia en estos pacientes. La prevalencia de dislipemia es 2 a 3 veces más frecuente en la población con diabetes que en la que no tiene diabetes, aproximadamente 40- 60%.
La dislipemia diabética se caracteriza por hipertrigliceridemia, aumento de las lipoproteínas de muy baja densidad (VLDL), disminución de los niveles de las lipoproteína de alta densidad (HDL), aumento leve-moderado de la concentración del colesterol de la lipoproteínas de baja densidad (LDL) con predominio de partículas LDL pequeñas y densas (LDLpq), aumento de la apolipoproteína B (ApoB), aumento de los ácidos grasos libres (AGL), y aumento de partículas residuales o remanentes ricas en triglicéridos(17-20).
La secuencia se inicia por la incapacidad de la insulina en condiciones de insulinorresistencia de suprimir la actividad de la lipasa del tejido adiposo, lo que se asocia a una mayor lipólisis, y liberación de ácidos grasos y glicerol. Así, el flujo aumentado de ácidos grasos al hígado estimularía la secreción de partículas de VLDL. La mayor concentración de AGL unidos a albúmina incrementa la síntesis y secreción de VLDL, ricas en Apo B, hecho que explicaría la hipertrigliceridemia en los sujetos con DMT2. El intercambio de triglicéridos desde las VLDL hacia las LDL y HDL por la proteína de transferencia de esteres de colesterol (CEPT), conllevaría a un enriquecimiento de TG de estas lipoproteínas. Las partículas de LDL ricas en triglicéridos son transformadas por la lipasa hepática en partículas pequeñas y densas (LDLpd), conocido como fenotipo B de las LDL, asociado a un riesgo aumentado de enfermedad coronaria, y este fenotipo se asocia a enfermedades con elevado riesgo cardiovascular, incluyendo la DMT2(21). Por otro lado, se ha descrito un aumento de la Apo B en DMT2, debido a un incremento de la síntesis hepática por la sobreproducción de VLDL y su enriquecimiento en TG(22).
La enzima CEPT aumenta el contenido de triglicéridos en las HDL, transformándolas en HDL pequeñas y densas, potencialmente disfuncionales, que al ser hidrolizadas por la lipasa hepática sufren un proceso de disociación, liberando la fracción apoproteica, que es captada y excretada a nivel renal, incrementando su catabolismo. Adicionalmente se ha propuesto que la presencia de citocinas proinflamatorias, especialmente por el TNF- α contribuye a la baja concentración de las HDL por disminución de la síntesis hepática de la apolipoproteína A-I(23).
Por lo antes expuesto, se quiere saber si los niveles séricos de Interleucina-6 se modifican en los pacientes con DMT2 en relación con el perfil lipídico debido a que los mediadores proinflamatorios desempeñan su papel crucial para inducir las complicaciones de la diabetes, mediante la participación del estrés oxidativo y la activación de varias vías moleculares y/o metabólicas mediadas por la transcripción. En este trabajo se evaluaron los niveles séricos de interleucina 6 en pacientes diabéticos tipo 2 y su correlación con el perfil lipídico.
MÉTODOS
La población estuvo constituida por los sujetos con DMT2 que acudieron a la consulta de Endocrinología del Hospital Militar Universitario Dr. Carlos Arvelo durante Julio 2019 a febrero 2020 y la muestra estuvo conformada por 60 sujetos de ambos sexos, entre 40 a 60 años, con un Índice de Masa Corporal entre 20 y 30 Kg/ m2, que firmaron el consentimiento informado, conforme con la declaración de Helsinki y con la aprobación del comité de ética del Hospital. excluyéndose individuos con diabetes tipo 1 o gestacional, con enfermedades renal crónica estadio 5, degenerativas del tejido conectivo aguda o crónicas inflamatorias y vascular del colágeno, con deficiencias motoras, alcoholismo.
A los sujetos del estudio, se les realizó una historia clínica sobre patologías previas y concomitantes, examen físico completo con mediciones antropométricas (peso y talla, índice de masa corporal, circunferencias de cintura y cadera) mediciones de composición corporal por la técnica de bioimpedancia (masa libre de grasa y masa grasa), medición de la tensión.
Evaluación bioquímica: A cada sujeto en ayuno de 14 horas se les determino: colesterol total, colesterol de las HDL y LDL, triglicéridos y glucemia, en ayunas por método enzimático colorimétrico por Randox, en el equipo HITACHI 912 e interleucina-6 por el método de Elisa de la casa Comercial de Cayman. Determinación de no HDL por modelo matemático según Castro y et al (2004)(24).
Tratamiento Estadístico: Para el análisis estadístico los datos fueron tabulados bajo Excel® 2010, siendo procesados con SPSS® 19.0 en el cual se aplicaron estadísticas descriptivas como la media y la desviación estándar, para describir el comportamiento de la muestra a evaluar. Se aplicó la prueba “t” de student, las variables cualitativas se expresaron con frecuencias y porcentajes, y en todos los casos se estableció un nivel de significación de p<0,05.
RESULTADOS
Se incluyeron en el estudio 60 individuos, con edades entre 33 y 60 años, con promedio de 51,60 años ± 6,51, donde el 71,6% eran de sexo femenino y el 28,3% masculino, con tiempo de evolución de diabetes entre 1 mes y 37 años, (media= 10,97 años). Para las medidas antropométricas, según el IMC los pacientes en promedio tenían sobrepeso (29,7 ± 5,61), la CC por encima de los valores de referencias, el porcentaje de grasa corporal y MME elevados, la presión arterial sistólica (PAS) y diastólica (PAD) en valores normales. En cuanto a la glucemia el promedio fue de 126,28 ± 33,14 mg/dL. Con respecto al perfil lipídico se encontró los triglicéridos, LDL, VLDL y no-HDL dentro de los valores normales, mientras que el colesterol estaba elevado y las HDL bajas (Tabla 1). La Interleucina-6 se encontraba elevada en (5,64 ± 3,20), siendo el valor normal de 1,0 pg/dl, como lo señala Ridker et al., 2020(25) (Tabla 1).
| n | Min | Máx | Media | Desv. Típ. | |
| Edad (años) | 60 | 33 | 60 | 51,60 | 6,515 |
| Peso (kg) | 60 | 43,3 | 120,1 | 77,52 | 16,17 |
| Talla (cm) | 60 | 144,0 | 181,0 | 161,06 | 8,69 |
| IMC (kg/m2) | 60 | 17,1 | 44,1 | 29,74 | 5,61 |
| Circunferencia Cintura(cm) | 60 | 70,0 | 130,0 | 99,96 | 12,69 |
| % Grasa | 60 | 16,0 | 52,5 | 36,92 | 10,34 |
| Masa musculo esquelética MME (Kg) | 60 | 15,3 | 43,5 | 26,19 | 5,87 |
| Tiempo de evolución de la diabetes (años) | 60 | 1 | 37 | 10,97 | 8,11 |
| Presión arterial sistólica (mm/Hg) | 60 | 100 | 150 | 124,10 | 11,89 |
| Presión arterial diastólica (mm/Hg) | 60 | 70 | 110 | 84,07 | 8,97 |
| Glucemia (mg/dl) | 60 | 63 | 187 | 126,28 | 33,14 |
| Colesterol (mg/dl) | 60 | 88,0 | 328,0 | 181,46 | 45,82 |
| Triglicéridos (mg/dl) | 60 | 37,0 | 353,0 | 135,93 | 69,98 |
| HDL (mg/dl) | 60 | 17,8 | 73,1 | 35,95 | 12,27 |
| LDL (mg/dl) | 60 | 52,1 | 210,4 | 118,32 | 35,25 |
| VLDL (mg/dl) | 60 | 7,4 | 70,6 | 27,177 | 13,97 |
| no-HDL (mg/dl) | 60 | 68,4 | 255,9 | 145,51 | 42,15 |
| Interleucina-6 (pg/dl) | 60 | 3,3 | 17,8 | 5,646 | 3,20 |
Al analizar los resultados y establecer la correlación de IL6 con diferentes parámetros, se encontró una correlación baja positiva (r=0,3090) con la edad para pacientes diabéticos tipo 2, estadísticamente significativa (p=0,0163) (Figura 1).
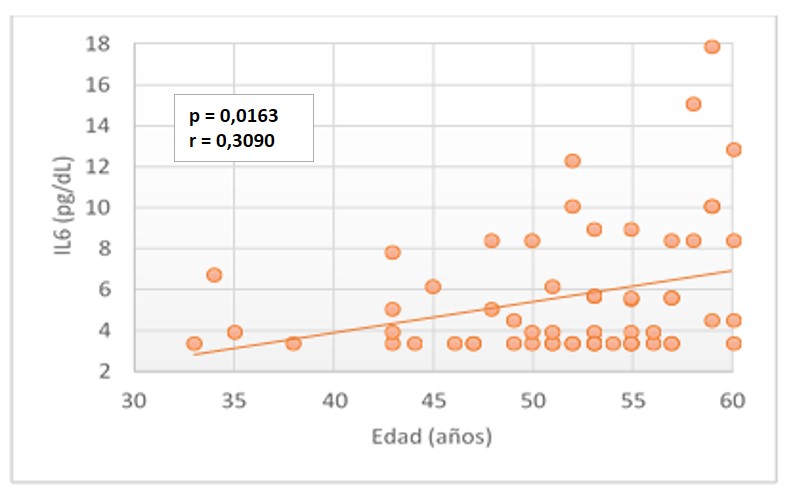
No se encontró correlación estadísticamente significativa entre la IL-6 y otros parámetros como tiempo de evolución de la diabetes (r = -0,05003; p= 0,7042), parámetros antropométricos como: IMC (r = 0,1842; p = 0,1590), CC (r = 0,1340; p = 0,3075), componentes de la composición corporal como % grasa (r = 0,04906; p = 0,7097) y MME (r = 0,08006; p = 0,5431) y de parámetros bioquímicos como glucemia (r = 0,05102; p = 0,6987), colesterol (r = 0,2373; p = 0,0679), HDL (r = 0,1151; p = 0,3811 y LDL (r = 0,1232; p = 0,3485) en los pacientes DMT2.
Pero si se encontró una correlación positiva baja estadísticamente significativa entre IL-6 y los parámetros de triglicéridos (r = 0,3659; p = 0,0040), VLDL (r = 0,3659; p = 0,0040) y no-HDL (r = 0,3659; p = 0,0040), en los pacientes DMT2, como se observa en las figuras 2, 3 y 4.
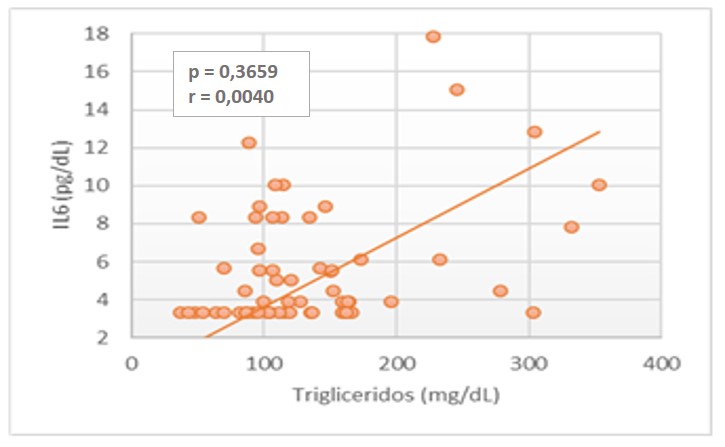
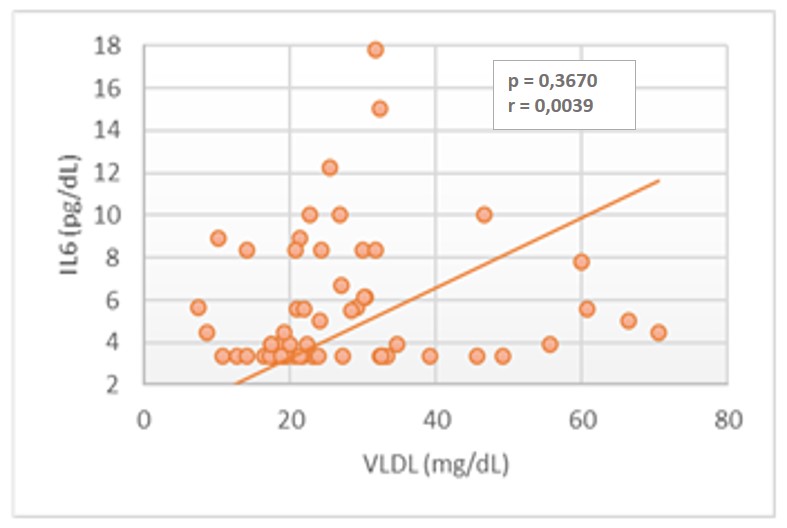
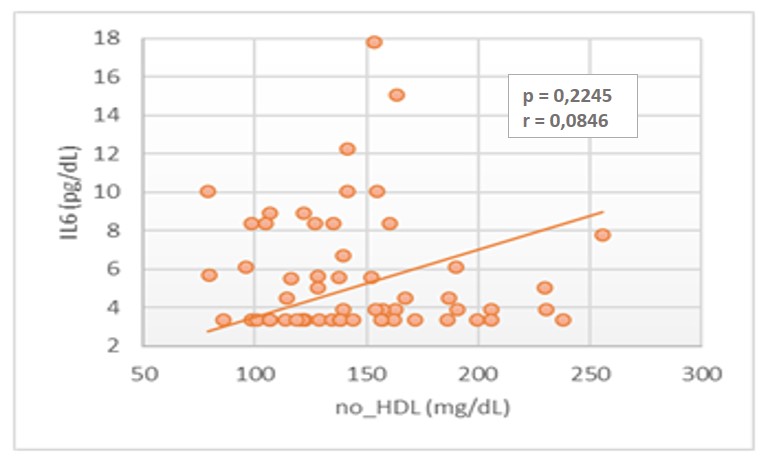
DISCUSIÓN
En pacientes con diabetes tipo 2, Fontana Rodríguez et al(16), señalan que los niveles de IL-6 son más altos, frente a los controles. Ellos señalan que IL-6 es una citocina que se produce asociada a procesos inflamatorios, que es multifuncional y es secretada por muchos tipos de células, principalmente células T, macrófagos, células endoteliales, células de músculo liso, adipocitos y hepatocitos. Además, la IL-6 regula / estimula la producción de moléculas de adhesión celular, mediadores quimiotácticos y proteína de fase aguda, y media la liberación de otras citocinas que amplifican la respuesta inflamatoria(16). Sindhu et al 2015 también plantea que la IL-6 es una citocina secretada por macrófagos, adipocitos, fibroblastos y células endoteliales se encuentra estrechamente relacionada con el peso corporal y el metabolismo de los lípidos(26). Otros autores como Hansen et al., 2010; Goyal et al., 2012 también encontraron resultados de valores más altos de IL-6 en pacientes diabéticos tipo 2 obesos(27-28), en nuestros pacientes, aunque no eran obesos, si presentaban sobrepeso lo cual puede influir con la alteración de estos valores de interleucina-6.
Obregón y Aure, 2009 señalan que la acumulación de lípidos en el adipocito que se observa en la obesidad inicia un estado celular de estrés (estrés del retículo endoplásmico) y activación de c-Jun N-terminal kinasa (JNK) e IkB kinasa/factor nuclear kB (IKKB/NF-kB), que han sido caracterizado a través de un clásico mecanismo mediado por receptores. Estas kinasas ejercen un efecto importante en la expresión de genes, incluyendo genes involucrados en la respuesta inflamatoria. El estrés celular que incluye aumento de especies reactivas de oxígeno y el estrés del retículo endoplasmático, también activa la JNK y la IKKB y regula la producción de varias citoquinas incluyendo el FNT-α. Un alto porcentaje de radicales libres, es producido cuando hay aumento en la ingesta de calorías, ácidos grasos saturados y sedentarismo. El aumento en la producción de radicales libres, generado por la mitocondria, puede producir daño del ADN y deterioro de componentes lipídicos de la membrana, ocasionando disfunción mitocondrial. Esta disfunción mitocondrial lleva a inflamación resistencia a la insulina estrés oxidativo y apoptosis(29).
Se podría decir que por cualquier vía que se active el estrés oxidativo va a dañar a la mitocondria y al dañarse la mitocondria se estimula la vía la inflamación y esa vía lleva a la producción en el hígado IL1, IL6, FNT α y PCR y todos los factores de la inflamación.
El estado de hiperglucemia induce la producción de IL-6 desde el endotelio y los macrófagos, y con ello, se produce un empeoramiento de la liberación de insulina y de las cascadas de señalización. También es conocido que el estado de insulinorresistencia promueve la lipolisis, de tal forma que se incrementa la formación de partículas de LDL (lipoproteínas de baja densidad) pequeñas y densas(30). Lo cual se asocia a un aumento del riesgo de arteriosclerosis (31). Sin embargo, en nuestros pacientes no se encontró elevación de la LDL, aunque no se realizó su fraccionamiento de lipoproteínas LDL para conocer su patrón, si eran tipo A o tipo B.
Se observó en el grupo de pacientes diabéticos tipo 2 con dislipidemia una correlación positiva entre el valor de IL6 y los parámetros de triglicéridos, VLDL y no-HDL. Dentro de las enfermedades metabólicas como la DM, la hipertrigliceridemia que es el tipo de dislipidemia más común.
Los pacientes con sobrepeso u obesidad, síndrome metabólico y diabetes presentan hipertrigliceridemia y especialmente lipemia postprandial, bajo estas circunstancias las características fenotípicas de los lípidos incluyen un crecimiento en el número de partículas enriquecidas con triglicéridos como VLDL, IDL y LDL patrón B (partículas pequeñas y densas) y la HDL, que se hacen pequeñas y disfuncional Sarwar et al., 2007(32). Es importante recordar que en todos estos trastornos metabólicos existe liberación de ácidos grasos libres por una lipolisis aumentada lo cual lleva a inflamación con liberación de citoquinas proinflamatorias como IL-6, FNTα. Esto pudiera explicar la relación encontrada en nuestros pacientes entre lipoproteínas ricas en triglicéridos e IL-6 elevada.
La VLDL ricas en triglicéridos se han visto involucradas en la disminución de la producción moléculas vasoactivas con ON y la prostaglandina y la producción de tromboxanos, las cuales pueden mediar los procesos inflamatorios(29).
Ponte en el 2009 señala la elevación de los triglicéridos en sangre como factor independiente del riesgo cardiovascular, donde evidencia desde el punto de vista epidemiológico, clínicas y fisiopatológicas, que la presencia en sangre las concentraciones anormales altas de partículas cargadas de triglicéridos, vistas sobre todo en pacientes con resistencia a la insulina son un factor etiopatogénico clave en el proceso patológico que lleva a desarrollar ateroesclerosis y eventos cardiovasculares(33).
Cada vez hay más evidencias que muestran que pacientes con DM presentan un aumento en el estrés oxidativo y los procesos de inflamación, siendo mayores en aquellos que presentan complicaciones propias de la patología, caracterizadas por una disminución en la actividad de los sistemas antioxidantes y un incremento de los productos de oxidación(34-36). Como en el caso en este estudio de los pacientes diabéticos dislipidémicos donde se encontró un aumento de los marcadores de inflamación posiblemente relacionados a alteraciones metabólicas como un aumento en los valores de glucemia, triglicéridos, VLDL y colesterol y una disminución de HDL.
Por todo lo antes señalado podríamos decir que en los pacientes diabéticos con dislipidemia hay una serie de factores desencadenantes que pueden conducir a un aumento de estrés oxidativo y de moléculas proinflamatorias que conducen a mayor riesgo cardiovascular.
CONCLUSIÓN
En los resultados de nuestro estudio se encontró valores elevados de IL6 en todos los pacientes diabéticos tipo 2, lo cual coincide con otros trabajos reportados. Además, se encontró una correlación positiva entre IL6 y las lipoproteínas ricas en triglicéridos.
Esto respalda la idea de que la hipertrigliceridemia puede causar cambios inflamatorios en pacientes diabéticos y esto elevaría el riesgo cardiovascular de estos pacientes.
REFERENCIAS
1. Nieto R, Marulanda M, González J, Ugel E, Durán M. Estudio Venezolano de salud cardiometabólica Evescan. Rev. Sociedad Venezolana de Medicina Interna. 2017.
2. Le Roit D, Taylor SI, Olefssky JM. Diabetes Mellitus. Texto básico y clínico. 2ª ed. Ed. Mc-Graw Hill, Interamericana. México, D.F.2003; 1331.
3. Secretaría de Salud Modificación a la Norma Oficial Mexica-na, NOM-015-SSA2- 1994, para la prevención, tratamiento y control de la diabetes mellitus en la atención primaria. México D.F.: Diario Oficial de la Federación, 7 de abril 2000.
4. Crook MA, Tutt P, Pickup JC. Concentración sérica elevada de ácido siálico en la DMNID y su relación con la presión arterial y la retinopatía. Cuidado de la diabetes. 1993; 16 (1): 57-60.
5. Pickup JC, Mattock MB, Chusney GD, Burt D. NIDDM como una enfermedad del sistema inmunitario innato: asociación de reactantes de fase aguda e interleucina-6 con síndrome metabólico-X. Diabetologia. 1997; 40 (11): 1286-92.
6. Pradhan AD, Manson JE, Rifai N, Buring JE, Ridker PM. Proteína C reactiva, interleucina 6 y riesgo de desarrollar diabetes mellitus tipo 2. Jama 2001; 286 (3): 327-34.
7. Meigs JB, Hu FB, Rifai N, Manson JE. Biomarcadores de disfunción endotelial y riesgo de diabetes mellitus tipo 2. Jama 2014; 291 (16): 1978-86.
8. Gabay C. Interleucina-6 y la inflamación crónica. Artritis de Investigación y Terapia. 2006; 8 (Suppl 2): 3.
9. Dinarello, AC. 2000. Proinflammatory cytokines. Chest; 118: 503-508.
10. Akira S, Taga T, Kishimoto T: Interleukin-6 in biology and medicine. Adv Immunol. 1993; 54: 1-78.
11. Pedersen BK, Steensberg A, Fischer C, Keller C, Keller P, Plomgaard P, Febbraio M, Saltin B: Searching for the exercise factor: is IL-6 a candidate? J Muscle Res Cell Motil. 2003; 24: 113-119.
12. Beisswenger P.I., Drummond K.S., Nelson R.G., Howell S.K., Szwergold B.S., Mauer M. Susceptibility to diabetic nephropathy is related to dicarbonyl and oxidative stress. Diabetes.2005; 54:3274-81.
13. Moreira E.D., Neves R.C., Nunes Z.O., de Almeida M.C., Mendes A.B., Fittipaldi J.A. Glycemic control and its correlates in patients with diabetes in Venezuela: results from a nationwide survey. Diabetes Res Clin Pract.2010;87:407-14.
14. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, et al.; American Diabetes Association (ADA); European Association for the Study of Diabetes (EASD). Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2012; 35:1364-79.
15. Mohamed Abdelrahman. Evaluación de la interleucina 6, la proteína C reactiva de alta sensibilidad y los niveles de perfil de lípidos en sudaneses con diabetes mellitus tipo 2. 5 ª Conferencia Internacional de Química Médica y asistido por ordenador de Drogas El diseño y la administración de fármacos December 05-07, 2016 Phoenix, USA.
16. Fontana Rodrigues. Niveles / polimorfismos de IL-6, TNF-α e IL-10 y su asociación con diabetes mellitus tipo 2 y obesidad en individuos brasileños. Arco. Endocrinol Metab. 2017; 61 (5).
17. Barter PJ, Ballantyne CM, Carmena R, Castro-Cabezas M, Chapman MJ, Couture P. Apo B versus cholesterol in estimating cardiovascular risk and in guiding therapy: report of the thirty-person/ten-country panel. J Intern Medicine 2006; 259: 247–258.
18. Wagner AM, Perez A, Calvo F, Bonet R, Castellvi A, Ordonez J: Apolipoprotein(B) identifies dyslipidemic phenotypes associated with cardiovascular risk in normocholesterolemic type 2 diabetic patients. Diabetes Care 1999; 22(5):812-817.
19. Wagner AM, Perez A: [Diabetic dyslipidemia: assessment and treatment]. Med Clin (Barc ) 2002; 119(7):260-264.
20. Mooradian AD: Dyslipidemia in type 2 diabetes mellitus. Nat Clin Pract Endocrinol Metab 2009; 5(3):150-159.
21. Krauss RM: Lipids and lipoproteins in patients with type 2 diabetes. Diabetes Care 2004; 27(6):1496-1504.
22. Ginsberg HN: Insulin resistance and cardiovascular disease. J Clin Invest 2000; 106(4):453-458.
23. Beers A, Haas MJ, Wong NC, Mooradian AD: Inhibition of apolipoprotein AI gene expression by tumor necrosis factor alpha: roles for MEK/ERK and JNK signaling. Biochemistry 2006; 45(7):2408-2413.
24. Castro J, Lares M, Obregón O. El Colesterol no HDL como marcador de riesgo cardiovascular 2004; 29 (1/2): 3-6
25. Paul M. Ridker, Jean G: MacFadyen, Robert J. Glynn, Gary Bradwin, Ahmed A. Hasan, and Nader Rifai Comparison of interleukin-6, C-reactive protein, and low-density lipoprotein cholesterol as biomarkers of residual risk in contemporary practice: secondary analyses from the Cardiovascular Inflammation Reduction Trial. European Heart Journal 2020; 41, 2952-2961.
26. Sindhu S, Thomas R, Shihab P, Sriraman D, Behbehani K, Ahmad R. 2015. Obesity is a Positive Modulator of IL-6R and IL-6 Expression in the Subcutaneous AdiposeTissue: Significance for Metabolic Inflammation. PLoS One 2015; 10 (7): e0133494.
27. Dominique Hansen, Paul Dendale, Milou Beelen, Richard AM Jonkers, Annelies Mullens, Luk Corluy, Romain Meeusen, yLuc JC van Loon, Plasma Adipokine and inflammatory marker concentrations are altered in obese as opposed to non-obese, type 2 diabetes patients European Journal of Applied Physiology 2010, 109,379-404.
28. Goyal R, Faizy AF, Siddiqui SS, Singhai M. Evaluation of TNF-α aand IL-6 in obese and non-obese Diabetics: Pre – and postinsulin effects. N Am J Med Sci 2012; 4: 180-4.
29 Obregon O, Aure G, Disfunción mitocondrial y mecanismos fisiopatológicos relacionados con la dislipidemia del síndrome plurimetabolico, Aterosclerosis al día VII. Publicación de la asociación de la sociedad venezolana de ateroesclerosis, caracas: ediciones AVA; 2009 p;170-181.
30. Marsh JB: Lipoprotein metabolism in obesity and diabetes: insights from stable isotope kinetic studies in humans. Nutr Rev 2003; 61(11):363-375.
31. Austin MA, King MC, Vranizan KM, Krauss RM: Atherogenic lipoprotein phenotype. A proposed genetic marker for coronary heart disease risk. Circulation 1990; 82(2):495-506.
32. Sarwar N, Danesh J, Eiriksdottir G, Sigurdsson G, Wareham N, Bingham S, et al. Triglycerides and the risk of coronary heart disease 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation 2007;115:450-8.
33. Ponte C, Isea-P J. Machado L, Sánchez O, Melendéz R, Feijo J. The 2009 World Congress of Cardiology Abstracs. Buenos Aires, Argentina, May 18-21, 2009: poster presentations circulation.
34. Kaneto H, Katakami N, Matsuhisa M, Matsuoka TA (2010) Role of Reactive Oxygen Species in the Progression of Type 2 Diabetes and Atherosclerosis. Mediators Inflamm 2010: Article ID 453892,1 pages, doi:10.1155/2010/453892.
35. Likidlilid A, Patchanans N, Peerapatdit T, Sriratanasathavorn C. (2010) Lipid peroxidation and antioxidant enzyme activities in erythrocytes of type 2 diabetic patients. J Med Assoc Thai 93(6):682-693.
36. Takayanagi R, Inoguchi T, Ohnaka K (2011) Clinical and experimental evidence for oxidative stress as an exacerbating factor of diabetes mellitus. J Clin Biochem Nutr 48 (1): 72-77.
Información adicional
Cómo citar: Escalera J, Pérez L, Brito S, Lares M, Flores L, Castro J. Niveles séricos de
interleucina-6 en pacientes con diabetes tipo 2 y su correlación con el perfil
lipídico. Rev Digit Postgrado. 2021;10(2): e309. doi: 10.37910/RDP.2021.10.2.e309
Conflicto de interés: los autores declaran no tener conflicto de interés.

